Научно-практический медицинский рецензируемый журнал «Эндокринная хирургия» - первое в России периодическое издание, посвященное проблемам диагностики и хирургического лечения различных заболеваний эндокринной системы. В данном научно-практическом издании рассматриваются медико-технические вопросы хирургических подходов к лечению не только эндокринных заболеваний, но и проблемы хирургического лечения осложнений сахарного диабета, в частности синдрома диабетической стопы, диабетической офтальмопатии и т.д.
Успех лечения заболеваний в этой области зависит от тесного взаимодействия врачей разных медицинских специальностей – эндокринологов, хирургов, онкологов, радиологов, патоморфологов, анестезиологов-реаниматологов, генетиков – с использованием самых современных высокотехнологичных методов диагностики, лечения и реабилитации. Журнал «Эндокринная хирургия» призван собрать и обобщить мнения всех этих специалистов на своих страницах, но при этом гарантирует строгие критерии отбора статей, основанных на принципах доказательной медицины и международных стандартов.
Необходимость издания журнала «Эндокринная хирургия» обусловлена целым рядом факторов. Это и огромное количество больных, нуждающихся в специализированной медицинской помощи, и появление большого числа специалистов, занимающихся хирургией эндокринных органов. При этом на сегодняшний день в нашей стране отсутствуют отраслевые стандарты лечения, равно как и регистры больных.
Основными источниками, которыми руководствуются специалисты при лечении эндокринных заболеваний, служат различные пособия по хирургии, эндокринологии и онкологии, которые зачастую несут противоречивую и взаимоисключающую информацию. Практика разработки консенсусных решений по мере получения новой информации и возникновения серьезных изменений в диагностике и лечении заболеваний, принятая во многих профессиональных ассоциациях, в России пока не прижилась. В связи с этим в журнале «Эндокринная хирургия» акцентировано внимание на клинических рекомендациях международных ассоциаций по актуальным проблемам эндокринной хирургии, обозреваются наиболее интересные публикации иностранной литературы, основанные на принципах доказательной медицины.
Текущий выпуск

Клиническая лекция 
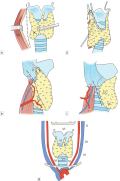
В данной лекции представлены 3 метода тиреоидэктомии. Наиболее распространенный и актуальный — метод экстрафасциальной тиреоидэктомии (1), исторический метод субкапсулярной тиреоидэктомии (2) и комбинированный метод экстрафасциальной и субфасциальной тиреоидэктомии (3). Каждый из них используется в повседневной практике и имеет свои показания к использованию. Методы тиреоидэктомии представлены с детальным и последовательным описанием шагов. В описании методики операции определена этапность. Представленные три метода тиреоидэктомии являются систематизированием существующих широко используемых хирургических методов операции при различных заболеваниях щитовидной железы. По нашему мнению, данный систематизированный пошаговый подход к тиреоидэктомии с учетом особенностей патологии щитовидной железы может улучшить стандарты лечения, исходы операции и обучение хирургов в области хирургии щитовидной железы (ЩЖ).
Оригинальное исследование 
Обоснование. Сахарный диабет (СД) — одно из самых распространенных хронических заболеваний, приводящее к развитию множества осложнений, в том числе к синдрому диабетической стопы (СДС). Проблема прогрессивного увеличения численности пациентов с СДС и высокий риск ампутации в популяции пациентов с СД требует проведения исследований с целью установления факторов риска и конкретизации способов их коррекции.
Цель. Изучить клинико-лабораторные характеристики пациентов центра спасения конечностей, страдающих СД 2 типа (СД2).
Материалы и методы. Проведен ретроспективный анализ 729 историй болезни пациентов с СД2 центра спасения конечностей ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» с 2019 по 2020 гг. Проведен анализ анамнестических данных, клинико-лабораторных показателей, медикаментозной терапии, характера хирургического вмешательства и исхода госпитализации. Статистический анализ проводился с помощью программы STATISTICA 8.0.
Результаты. В исследование было включено 729 пациентов с СД2. Среди них преобладали мужчины (58%). Медиана возраста больных составила 66 [59,0; 73,0] лет. У 50,89% пациентов стаж диабета превышал 10 лет. У 53% из них имелся СДС в анамнезе, у 79,2% — диабетическая полинейропатия, у 45% ранее проводилась ампутация нижней конечности, у 24,8% — реваскуляризация сосудов нижних конечностей. Значительная часть пациентов при поступлении находилась в состоянии декомпенсации углеводного обмена. Медиана уровня тощаковой гликемии составила 9,9 ммоль/л [7,2; 13,8]. Медиана HbA1c составила 7,8% [6,7; 9,1]. ИМТ и липидный профиль были оценены не у всех. В отделении был впервые поставлен диагноз СДС 224 пациентам. Среди язвенно-некротических осложнений СДС преобладала гангрена. Среди сопутствующей патологии — артериальная гипертензия (АГ). СКФ ˂ 60 мл/мин/1,73 м2 имели 45,36% пациентов. По данным рентгенографии, у 27,16% пациентов (107 из 394) имелись признаки нарушения костной плотности. В отделении 113 больным провели реваскуляризацию, 372 — ампутацию нижней конечности, при этом 37 пациентам (9,95%) была проведена ампутация на уровне выше колена, а 335 (90,05%) — ниже колена. Только местное лечение среди пациентов с СДС получили 244 человека. Всего были выписаны 718 пациентов; умерли 11. Медиана продолжительности госпитализации выписанных пациентов составила 13,0 [9,0; 18,0] койко-дней, средняя длительность госпитализации умерших пациентов — 11,31±2,21 (95% ДИ 6,49–16,13) койко-дней.
Заключение. Большая часть пациентов с СД2 и СДС имели длительную декомпенсацию углеводного обмена, дислипидемию, повышенный ИМТ, АГ. В ходе исследования был сделан вывод о важности мониторинга и коррекции факторов риска для улучшения прогноза течения заболевания.
Эндокринная онкология 
В данном тезисе представлено клиническое наблюдение пациентки с диагнозом «Нейроэндокринная опухоль поджелудочной железы с метастатическим поражением печени и брюшины». Возраст больной на момент постановки диагноза — 18 лет.
Описание случая. Представляется клиническое наблюдение пациентки с диагнозом «Нейроэндокринная опухоль хвоста поджелудочной железы G2, рТ3N1M1 (печень, брюшина)». Хирургическое лечение от 25.07.2022 — резекция поджелудочной железы, биопсия МТС в печени. При гистологическом исследовании — нейроэндокринная опухоль, G2 рТ3N1в печени обнаружены метастазы аналогичного строения, Ki-67 до 10%. SSTR2(++), SSTR5(++). На момент постановки диагноза пациентке 18 лет. Из анамнеза известно, что с 14 лет больная наблюдалась у психотерапевта и получала ингибиторы обратного захвата серотонина и у гастроэнтеролога с диагнозом «Синдром раздраженного кишечника». Хромогранин А, серотонин крови, 5-ОИУК в моче в рамках референсных значений. При отсутствии данных относительно биохимического карциноидного синдрома, у пациентки имеется клинический карциноидный синдром, который представляет из себя следующий симптомокомплекс: диарея 1 степени, эмоциональная лабильность, периодические приливы. С ноября 2022 года — состояние на фоне терапии ланреотидом. При МРТ от июня 2023 г. — в печени множество мелких метастазов в обеих долях печени размером 4–5 мм в диаметре. С целью локального контроля выполнена селективная химиоэмболизация печеночных артерий (20 мл лекарственно-насыщаемых эмбосфер насыщенных 50 мг доксорубицина до полной редукции кровотока). Также у пациентки выявлен редкий вариант патогенной соматической мутации-BRCA2c.5882_5884dupGTA.
Результаты. На фоне эффективного лечения, которое сочетает локальный и системный контроль над заболеванием, удалось купировать карциноидный синдром у молодой пациентки и достигнуть стабилизации заболевания.
Заключение. Стабильный рост заболеваемости нейроэндокринными опухолями ставит перед современной онкологией новые задачи. Приведенное клиническое наблюдение показывает нам новые паттерны поведения нейроэндокринных опухолей, а именно, что данное заболевание может возникать у молодых пациентов и быть связано с патогенной соматической мутацией BRCA.
Актуальность. Первичные новообразования сердца встречаются редко (0,1%), вторичные опухоли (6%) встречаются гораздо чаще. Первичные же опухоли подразделяют на: доброкачественные (75%) и злокачественные (25%). Сама же рабдомиосаркома сердца встречается в 20% от всех злокачественных заболеваний сердца.
Методы. В условиях Павлодарского областного кардиологического центра (ПОКЦ) в 2021 г. впервые выявлено образование в полости левого предсердия, с последующим оперативным лечением.
Описание случая. Пациентка, 54 года. Обратилась в ПОКЦ с жалобами на выраженную одышку при физической нагрузке, при ходьбе по горизонтальной поверхности на расстояние не более 150 метров. По данным эхокардиографии выявлено: образование в полости левого предсердия (8,7×6,0), с частичной обструкцией митрального клапана. После выполнения всех необходимых диагностических процедур пациентке проведено оперативное лечение: удаление образования полости левого предсердия, пластика дефекта межпредсердной перегородки, аннулопластика митрального клапана. Длительность оперативного вмешательства составила 280 минут, искусственное кровообращение 182 минуты, гипотермия до 32°С. Пребывание в реанимации 3 суток. Пациентка выписана для дальнейшего амбулаторного долечивания.
Карбоксипептидаза А3 (СРА3) является специфической протеазой тучных клеток (ТК) с вариабельной экспрессией и входит в число преформированных компонентов секретома. CPA3 принимает участие в регуляции состояния специфического тканевого микроокружения и компонентов интегративно-буферной метаболической среды при адаптивных и патологических процессах, затрагивая реализацию врожденного иммунитета, механизмы ангиогенеза, процессы ремоделирования межклеточного матрикса и др. Идентификация СРА3 c помощью протоколов мультиплексной иммуногистохимии позволяет конкретизировать детали органоспецифических популяционных характеристик тучных клеток, включая протеазный фенотип, механизмы биогенеза с цито- и гистотопографическими критериями, а также особенности секреторных путей. Особенности процессинга, аккумуляции и секреторных путей СРА3 вместе с фактами обильного содержания в ТК позволяют считать данную протеазу важной характеристикой протеазного фенотипа ТК и одним из ключевых компонентов органоспецифических характеристик их популяции. Особенности внутриклеточной солокализации СРА3 с другими специфическими протеазами тучных клеток, а также пространственное распределение СРА3+ тучных клеток в ткани с установлением закономерностей их солокализации с иммунокомпетентными и стромальными клетками формируют новые представления о фундаментальных механизмах регуляции состояния интегративно-буферной метаболической среды и внеклеточного матрикса. В то же время очевидно, что наши знания о биологических эффектах данной протеазы по сравнению с триптазой и химазой существенно ограничены. Будущие исследования прольют свет на механизмы вовлеченности СРА3 в патогенез различных заболеваний, и, что особенно важно, механизмы их зарождения на уровне специфического тканевого микроокружения. Таким образом, СРА3 составляет перспективную мишень в трансляционной медицине как с точки зрения диагностического значения, так и в качестве потенциальной мишени таргетной терапии. Дальнейшие исследования будут способствовать раскрытию истинной ценности характеристик экспрессии CPA3 ТК в качестве прогностического фактора и перспективной молекулярной мишени терапии социально значимых заболеваний.
Обоснование. Биологическое значение молекулы CD38 выходит за рамки метаболических, ферментативных и пролиферативных функций. Обладая одновременно функциями экзофермента и рецептора, СD38 активно задействован в механизмах адгезии, миграции, межклеточного сигналлинга, формировании иммунных синапсов и модуляции деятельности широкого спектра иммунных и неиммунных клеток. Однако детекция CD38 в тучных клетках (ТК) на срезах органов, фиксированных в формалине и заключенных в парафин, ранее не проводилась.
Цель. Иммуногистохимическая оценка цитологических и гистотопографических характеристик распределения CD38 в ТК кожи, молочной железы, небных миндалин и костного мозга.
Материалы и методы. В соответствии с дизайном эксперимента исследован биоматериал органов от пациентов с нейротрофическими язвами кожи, тонзиллитом, мастоцитозом, раком молочной железы и аденокарциномой поджелудочной железы. CD38 выявляли иммуногистохимически, для исследования цитотопографических закономерностей распределения фермента в ТК и выявления особенностей их гистотопографии использовалась мультиплексная технология окрашивания.
Результаты. Впервые показана возможность иммуногистохимической детекции CD38 в ТК на гистологических срезах различных органов. Экспрессия CD38 выявлялась в меньшей части популяции ТК и характеризовалось широкой вариабельностью от слабого до выраженного уровня. Содержание CD38 в ТК обладало органоспецифическими особенностями, а также зависело от развития патологических процессов в специфическом тканевом микроокружении. Проведенное исследование показывает принципиальную возможность детекции CD38 в тучных клетках на гистологических препаратах. Важное значение при этом имеют антитела, направленные на определенные эпитопы CD38, с чем связана их специфичность и эффективность детекции тучных клеток. Очевидно, что интенсивность экспрессии CD38 в тучных клетках обусловлена функциональной активностью. Детали этого механизма и особенности могут стать плодотворной почвой для будущих исследований в различных лабораториях. С другой стороны, CD38+ тучные клетки могут представлять собой отдельную субпопуляцию с характерными свойствами, что также заслуживает продолжения исследований тучных клеток с использованием омиксных технологий, включая геномные, транскриптомые, протеомные, липидомные и др. Чем больше информации будет получено о протеине CD38 и тучных клетках, тем более селективным может быть изменение статуса специфического тканевого микроокружения, включая формирование провоспалительного иммунного ответа и повышение эффективности элиминации опухоли.
Заключение. Технологии мультиплексной иммуногистохимии позволяют выявлять экспрессию СD38 в тучных клетках и исследовать взаимодействие тучных клеток с другими CD38+-мишенями в тканях, открывая новые представления о механизмах реализации эффектов преформированных компонентов секретома в норме и патологии.
Актуальность. По статистике папиллярный рак щитовидной железы является одним из самых частых онкологических заболеваний. Ввиду того, что папиллярный рак может долгое время протекать бессимптомно, обнаружение заболевания может быть случайным во время профилактического осмотра. В некоторых случаях папиллярный рак может образоваться из ранее доброкачественного узла, то есть путем малигнизации узла.
Описание случая. У женщины 23 лет во время профилактического осмотра было выявлено на УЗИ узловое образование в правой доле щитовидной железы (у нижнего полюса и в средней трети правой доли лоцируется изоэхогенное образование с четкими, относительно ровными контурами размерами 1,36×1,06 см). Было рекомендовано провести тонкоигольную пункционную биопсию. Результат цитологического исследования: фолликулярная опухоль с атипией, больше данных за папиллярный рак щитовидной железы. Далее пациентка была консультирована онкологом, рекомендовано оперативное лечение. Пациентке была проведена тотальная струмэктомия. Послеоперационная гистология: «Папиллярная карцинома щитовидной железы». Женщина взята на диспансерный учет с диагнозом «Послеоперационный гипотиреоз». Получает супрессивную терапию.
Результаты. На фоне приема ЗГТ: ТТГ — 0,17 мкМЕ/мл, что свидетельствует о компенсации гормонов щитовидной железы, состоянии медикаментозного эутиреоза. Пациентке был выставлен диагноз «Состояние после струмэктомии по поводу папиллярного рака щитовидной железы. Послеоперационный гипотиреоз средней тяжести, медикаментозная компенсация». Было рекомендовано продолжить прием левотироксина в супрессивной дозе.
Заключение. Таким образом, вышеописанный клинический случай подтверждает течение папиллярного рака щитовидной железы, который зачастую не проявляется клиническими симптомами и протекает бессимптомно, особенно в начале заболевания. Несмотря на то, что папиллярный рак описывается часто благоприятным прогнозом, некоторые варианты могут иметь агрессивный характер, что указывает на необходимость пункции «сомнительных» узлов и регулярный УЗИ-контроль узлов щитовидной железы для своевременного выявления малигнизации узлов или обнаружения новых злокачественных, а также необходимость использования гистологических маркеров для прогнозирования неблагоприятного течения папиллярного рака щитовидной железы.
Обоснование. АКТГ-эктопированный синдром — редкое заболевание, что связано со сложностями в своевременной его диагностике и часто приводит к ухудшению прогноза для пациента.
Материалы и методы. Описание 11 случаев АКТГ-эктопированного синдрома у пациентов, пролеченных в МОНИКИ за последние 15 лет.
Результаты. С 2008 по 2023 гг. в МОНИКИ им. М.Ф. Владимирского с подтвержденным диагнозом АКТГ-эктопированного синдрома наблюдались 11 пациентов: 6 мужчин и 5 женщин. Средний возраст 44 г. [36; 56,5]. В связи с нижеуказанными жалобами, исходно пациенты длительно наблюдались у врачей различных специальностей: терапевт/ кардиолог — 8 человек (жалобы на повышение АД и мышечную слабость), травматолог — 2 человека (низкотравматичные переломы и некроз шейки бедра), гинеколог — 1 (опухоль Бреннера). Таким образом, время от начала симптомов и до консультации эндокринолога МОНИКИ составило от 3 до 48 месяцев, медиана — 12 [9,5; 23] мес. При осмотре эндокринологом МОНИКИ основными жалобами были: мышечная слабость (11 пациентов), быстрая утомляемость (11), повышение АД (11), легкое образование гематом (9), перераспределение подкожно-жировой клетчатки (8), матронизм (8). Лабораторно: средний уровень АКТГ в 08:00 — 128 пг/мл [97,2; 127,3] при норме до 46 пг/мл; суточная моча на кортизол — 2321 нмоль/сут [2002,6; 13979,3], при норме до 485,6 нмоль/сут; средний уровень кортизола крови в 08:00 — 1145,379 нмоль/л [1095,98; 1545], при норме 101,2-535,7 нмоль/л. Гипокалиемия была у 7 пациентов. Выявлен и гистологически подтвержден источник АКТГ эктопии у 8 пациентов (легкие — 6, медуллярный рак щитовидной железы — 1, карциноид тимуса — 1), у 3 пациентов очаг АКТГ продукции не найден. За период наблюдения скончались 4 пациента.
Заключение. Несмотря на тяжелое течение гиперкортицизма у пациентов с АКТГ-эктопированным синдромом, в большинстве случаев начальные проявления могут быть неверно интерпретированы врачами, что приводит к задержке постановки диагноза и ухудшает прогноз для пациента. В лечении больных с АКТГ-эктопированным синдромом необходимы своевременная диагностика и мультидисциплинарный подход.
Актуальность. Генетическое и транскриптомное профилирование существенно расширяет инструментарий молекулярной диагностики онкозаболеваний. Для конкретной опухоли определяются короткие нуклеотидные замены в белок-кодирующих генах, генные амплификации и делеции, статус микросателлитной нестабильности, мутационная нагрузка опухоли, наличие опухолевых химерных онкогенов, статус ряда иммуногистохимических маркеров. Определяется наличие фармакогенетических вариантов, связанных с особенностями метаболизма противоопухолевых препаратов. Определяется уровень активности генов и молекулярных путей-мишеней свыше 170 таргетных противоопухолевых препаратов. На основании данной информации может быть построен персонализированный рейтинг противоопухолевых и химиотерапевтических препаратов.
Материалы и методы. Образец аденокортикального рака получили в виде парафинизированного блока ткани при хирургической операции. Брали срезы толщиной 10 мкм, после чего проводилась гистологическая характеристика, подсчет содержания опухолевых клеток в образце. Часть срезов использовали для определения геномного и транскриптомного профилей опухоли с помощью, соответственно, РНК-секвенирования и полноэкзомного секвенирования. При создании библиотек использовали метод истощения пула рибосомной РНК и целевого обогащения экзомных последовательностей гибридизационным методом. Анализ генетических профилей проводили с помощью программного обеспечения «Онкобокс» (Oncobox), нормировку экспрессионных профилей проводили на полученную при аутопсии погибших при ДТП коллекцию здоровых тканей человека ANTE. Для анализа молекулярных путей использовали базу знаний Oncobox PD.
Результаты. В результате молекулярного профилирования в образце пациента (мужчина, возраст 66 лет; содержание опухолевых клеток в образце 75%) не было обнаружено диагностических мутаций в генах BRCA1, BRCA2, ATM, BARD1, BRIP1, CHEK1, CHEK2, FAM175A, MRE11A, NBN, PALB2, RAD51B, RAD51C, RAD51D, RAD54L, NRAS (кодоны 12, 13, 59, 61, 117, 146), KRAS (кодоны 12, 13, 59, 61, 117, 146), BRAF (кодон 600), KIT (D816V), BRCA1 (мутации, нарушающие функцию белка), BRCA2 (мутации, нарушающие функцию белка), EGFR (делеции в 19 экзоне, замены L858R и T790M), PIK3CA (кодоны 420, 542, 546, 1047), ERBB2 (амплификация); в том числе не обнаружили мутации в генах системы репарации ДНК, что говорит о потенциально сниженной эффективности препаратов платины. Уровень мутационной нагрузки опухоли был установлен на уровне 19,9 на 1 миллион пар оснований (высокий уровень), микросателлитный статус — стабильный. Высокая мутационная нагруженность в данном случае может быть связана с наличием мутации в гене POLE (I1872N). Химерных онкогенов обнаружено не было. PD-L1 статус — отрицательный. Уровень экспрессии PD-1 и CTLA4 — ниже медианы для аденокортикального рака. Выявлена амплификация гена TUBA3D, кодирующего молекулярную мишень нескольких препаратов; других амплификаций мишеней известных таргетных препаратов не выявлено. С другой стороны, обнаружены мутации в генах CDKN2A, ТР53. Анализ экспрессии генов-мишеней таргетных препаратов выявил потенциально повышенную реактивность опухоли на терапию препаратами бевацизумаб (повышенная экспрессия VEGFA), виндезин, винкристин, винбластин (активация TUBA1A, TUBA1B, TUBA1C, TUBA3D*, TUBA8, TUBB, TUBB1, TUBB3, TUBB4A) и другими.
Заключение. На основании проведенного исследования пациенту была рекомендована в качестве резервной линии комбинированная терапия препаратом пембролизумаб (на основании высокой мутационной нагрузки опухоли), препаратом виндезин, отобранным на основании экспрессии молекулярных маркеров в исследуемой опухоли и на основе амплификации гена TUBA3D, а также бевацизумабом (на основании экспрессии молекулярных маркеров).
Актуальность. Генетическое и транскриптомное профилирование существенно расширяет инструментарий молекулярной диагностики онкозаболеваний. Для конкретной опухоли определяются короткие нуклеотидные замены в белок-кодирующих генах, генные амплификации и делеции, статус микросателлитной нестабильности, мутационная нагрузка опухоли, наличие опухолевых химерных онкогенов, статус ряда иммуногистохимических маркеров. Определяется наличие фармакогенетических вариантов, связанных с особенностями метаболизма противоопухолевых препаратов. Определяется уровень активности генов и молекулярных путей — мишеней свыше 170 таргетных противоопухолевых препаратов. На основании данной информации может быть построен персонализированный рейтинг противоопухолевых и химиотерапевтических препаратов.
Материалы и методы. Образец мелкоклеточного нейроэндокринного рака легкого получили в виде парафинизированного блока ткани при хирургической операции. Брали срезы толщиной 10 мкм, после чего проводилась гистологическая характеристика, подсчет содержания опухолевых клеток в образце. Часть срезов использовали для определения геномного и транскриптомного профилей опухоли с помощью, соответственно, РНК-секвенирования и полноэкзомного секвенирования. При создании библиотек использовали метод истощения пула рибосомной РНК и целевого обогащения экзомных последовательностей гибридизационным методом. Анализ генетических профилей проводили с помощью программного обеспечения «Онкобокс» (Oncobox), нормировку экспрессионных профилей проводили на полученную при аутопсии погибших при ДТП коллекцию здоровых тканей человека ANTE. Для анализа молекулярных путей использовали базу знаний Oncobox PD.
Результаты. В результате молекулярного профилирования в образце пациента (мужчина, возраст 61 год; содержание опухолевых клеток в образце 80%) не было обнаружено диагностических мутаций в генах ABRAXAS1, ALK, ATM, BARD1, BRAF, BRCA1, BRCA2, BRIP1, CHEK1, CHEK2, EGFR, ERBB2, FGFR3, IDH1, IDH2, KRAS, MET, MRE11A, NBN, NRAS, PALB2, PIK3CA, RAD51B, RAD51C, RAD51D, RAD54L, RET, в том числе в генах системы репарации ДНК, что говорит о потенциально сниженной эффективности препаратов платины. Выявлены герминальные варианты генов CYP3A5 *3/*3 (говорит о низком уровне метаболизма такролимуса), TPMT *1/*1 (говорит о нормальном уровне метаболизма схемы меркаптопурин + тиогуанин + азатиоприн). Уровень мутационной нагрузки опухоли был установлен на уровне 9,1 на 1 миллион пар оснований (пограничный уровень), микросателлитный статус — стабильный. Химерных онкогенов обнаружено не было. PD-L1 статус — отрицательный. Уровень экспрессии PD-1 u CTLA4 существенно ниже медианы для мелкоклеточного рака легкого. Амплификации 149 генов — мишеней известных таргетных препаратов не выявлено. С другой стороны, обнаружены мутации в генах RB1, ТР53. Анализ экспрессии генов-мишеней таргетных препаратов выявил потенциально повышенную реактивность опухоли на терапию препаратами эверолимус (повышенная экспрессия MTOR; активность молекулярного пути MTOR), эстрамустин (активация ESR1, ESR2, MAP2), винбластин, винкристин, виндезин и другие (активация TUBA1A, TUBA1B, TUBA1C, TUBA4A, TUBA4B, TUBA8, TUBB, TUBB3, TUBB4A, TUBB6-8).
Заключение. На основании проведенного исследования пациенту была назначена терапия эверолимусом, внесенным в клинические рекомендации для соответствующей нозологии, и препаратом винбластин, отобранным на основании экспрессии молекулярных маркеров в исследуемой опухоли.
Актуальность. Генетическое и транскриптомное профилирование существенно расширяет инструментарий молекулярной диагностики онкозаболеваний. Для конкретной опухоли определяются короткие нуклеотидные замены в белок-кодирующих генах, генные амплификации и делеции, статус микросателлитной нестабильности, мутационная нагрузка опухоли, наличие опухолевых химерных онкогенов, статус ряда иммуногистохимических маркеров. Определяется наличие фармакогенетических вариантов, связанных с особенностями метаболизма противоопухолевых препаратов. Определяется уровень активности генов и молекулярных путей-мишеней свыше 170 таргетных противоопухолевых препаратов. На основании данной информации может быть построен персонализированный рейтинг противоопухолевых и химиотерапевтических препаратов.
Материалы и методы. Образец неоперабельного медуллярного рака щитовидной железы получали в виде парафинизированного блока ткани при биопсии. Брали срезы толщиной 10 мкм, после чего проводилась гистологическая характеристика, подсчет содержания опухолевых клеток в образце. Часть срезов использовали для определения геномного и транскриптомного профилей опухоли с помощью, соответственно, РНК-секвенирования и полноэкзомного секвенирования. При создании библиотек использовали метод истощения пула рибосомной РНК и целевого обогащения экзомных последовательностей гибридизационным методом. Анализ генетических профилей проводили с помощью программного обеспечения «Онкобокс» (Oncobox), нормировку экспрессионных профилей проводили на полученную при аутопсии погибших при ДТП коллекцию здоровых тканей человека ANTE. Для анализа молекулярных путей использовали базу знаний Oncobox PD.
Результаты. В результате молекулярного профилирования в образце пациента (мужчина, возраст 48 лет) не было обнаружено диагностических мутаций в генах EGFR, BRAF, KRAS, PI3K, BRCA1-2, в генах системы репарации ДНК, что говорит о потенциально сниженной эффективности препаратов платины. Уровень мутационной нагрузки опухоли был установлен на уровне 3,1 на 1 миллион пар оснований, микросателлитный статус — стабильный. Химерных онкогенов обнаружено не было. PD-L1 статус — отрицательный. Уровень экспрессии PD-1 u CTLA4 — на уровне медианы для рака щитовидной железы. Амплификации 149 генов-мишеней известных таргетных препаратов не выявлено. С другой стороны, обнаружена мутация в гене RET (p.897_901del), мутация в генах CDKN2B, ТР63. Анализ экспрессии генов-мишеней таргетных препаратов выявил потенциально повышенную реактивность опухоли на терапию препаратами кабозантиниб, пралсетиниб и селперкатиниб (выявлена активация RET на мутационном и на экспрессионном уровнях).
Заключение. На основании проведенного исследования пациенту была назначена терапия кабозантинибом, внесенная в клинические рекомендации для лечения медуллярного рака щитовидной железы и отобранная на основании экспрессии молекулярных маркеров в конкретной опухоли.
Актуальность. Генетическое и транскриптомное профилирование существенно расширяет инструментарий молекулярной диагностики онкозаболеваний. Для конкретной опухоли определяются короткие нуклеотидные замены в белок-кодирующих генах, генные амплификации и делеции, статус микросателлитной нестабильности, мутационная нагрузка опухоли, наличие опухолевых химерных онкогенов, статус ряда иммуногистохимических маркеров. Определяется наличие фармакогенетических вариантов, связанных с особенностями метаболизма противоопухолевых препаратов. Определяется уровень активности генов и молекулярных путей — мишеней свыше 170 таргетных противоопухолевых препаратов. На основании данной информации может быть построен персонализированный рейтинг противоопухолевых и химиотерапевтических препаратов.
Материалы и методы. Образец мелкоклеточного нейроэндокринного рака легкого получили в виде парафинизированного блока ткани при хирургической операции. Брали срезы толщиной 10 мкм, после чего проводилась гистологическая характеристика, подсчет содержания опухолевых клеток в образце. Часть срезов использовали для определения геномного и транскриптомного профилей опухоли с помощью, соответственно, РНК-секвенирования и полноэкзомного секвенирования. При создании библиотек использовали метод истощения пула рибосомной РНК и целевого обогащения экзомных последовательностей гибридизационным методом. Анализ генетических профилей проводили с помощью программного обеспечения «Онкобокс» (Oncobox), нормировку экспрессионных профилей проводили на полученную при аутопсии погибших при ДТП коллекцию здоровых тканей человека ANTE. Для анализа молекулярных путей использовали базу знаний Oncobox PD.
Результаты. В результате молекулярного профилирования в образце пациента (мужчина, возраст 61 год; содержание опухолевых клеток в образце 80%) не было обнаружено диагностических мутаций в генах ABRAXAS1, ALK, ATM, BARD1, BRAF, BRCA1, BRCA2, BRIP1, CHEK1, CHEK2, EGFR, ERBB2, FGFR3, IDH1, IDH2, KRAS, MET, MRE11A, NBN, NRAS, PALB2, PIK3CA, RAD51B, RAD51C, RAD51D, RAD54L, RET, в том числе в генах системы репарации ДНК, что говорит о потенциально сниженной эффективности препаратов платины. Выявлены герминальные варианты генов CYP3A5 *3/*3 (говорит о низком уровне метаболизма такролимуса), TPMT *1/*1 (говорит о нормальном уровне метаболизма схемы меркаптопурин + тиогуанин + азатиоприн). Уровень мутационной нагрузки опухоли был установлен на уровне 9,1 на 1 миллион пар оснований (пограничный уровень), микросателлитный статус — стабильный. Химерных онкогенов обнаружено не было. PD-L1 статус — отрицательный. Уровень экспрессии PD-1 u CTLA4 существенно ниже медианы для мелкоклеточного рака легкого. Амплификации 149 генов — мишеней известных таргетных препаратов не выявлено. С другой стороны, обнаружены мутации в генах RB1, ТР53. Анализ экспрессии генов-мишеней таргетных препаратов выявил потенциально повышенную реактивность опухоли на терапию препаратами эверолимус (повышенная экспрессия MTOR; активность молекулярного пути MTOR), эстрамустин (активация ESR1, ESR2, MAP2), винбластин, винкристин, виндезин и другие (активация TUBA1A, TUBA1B, TUBA1C, TUBA4A, TUBA4B, TUBA8, TUBB, TUBB3, TUBB4A, TUBB6-8).
Заключение. На основании проведенного исследования пациенту была назначена терапия эверолимусом, внесенным в клинические рекомендации для соответствующей нозологии, и препаратом винбластин, отобранным на основании экспрессии молекулярных маркеров в исследуемой опухоли.
Актуальность. Транскриптомное профилирование существенно расширяет инструментарий молекулярной диагностики онкозаболеваний. Для конкретной опухоли определяются статус микросателлитной нестабильности, наличие опухолевых химерных онкогенов, статус ряда иммуногистохимических маркеров. Определяется уровень активности генов и молекулярных путей-мишеней свыше 170 таргетных противоопухолевых препаратов. На основании данной информации может быть построен персонализированный рейтинг противоопухолевых и химиотерапевтических препаратов.
Материалы и методы. Образец ткани нейроэндокринной опухоли неизвестной первичной локализации получали в виде парафинизированного блока ткани при хирургической операции печени. Брали срезы толщиной 10 мкм, после чего проводилась гистологическая характеристика, подсчет содержания опухолевых клеток в образце. Часть срезов использовали для определения геномного и транскриптомного профилей опухоли с помощью РНК-секвенирования. При создании библиотек использовали метод истощения пула рибосомной РНК. Анализ транскриптомных профилей проводили с помощью программного обеспечения «Онкобокс» (Oncobox), нормировку экспрессионных профилей проводили на полученную при аутопсии погибших при ДТП коллекцию здоровых тканей человека ANTE. Для анализа молекулярных путей использовали базу знаний Oncobox PD.
Результаты. В результате молекулярного профилирования образца пациента (мужчина, возраст 53 года) был установлен стабильный микросателлитный статус опухоли, химерных онкогенов обнаружено не было. PD-L1 статус — отрицательный. Анализ экспрессии генов-мишеней таргетных препаратов выявил потенциально повышенную реактивность опухоли на терапию препаратом эверолимус (транскрипционная активация гена MTOR), одобренным для лечения нейроэндокринных карциноидных опухолей, а также препаратов, находящихся на 2–3 фазе клинических испытаний для нейроэндокринных опухолей: рибоциклиб (выявлена активация RET — на экспрессионном уровне), темсиролимус (активация гена MTOR), панобиностат (активация генов гистондеацетилаз HDAC1, HDAC11, HDAC2, HDAC4, HDAC7, HDAC8), карфилзомиб (активация PSMB1, PSMB5), кабозантиниб (активация МЕТ). Кроме того, высокую позицию в рейтинге (третье место) потенциально эффективных препаратов занимал паклитаксел (активация генов BCL2, BCL2L1, MAP2, MAP4, MAPT, TUBA1A-С, TUBA3D, TUBA4A, TUBA4B, TUBA8, TUBB1, TUBB2B, TUBB4A).
Заключение. На основании проведенного исследования пациенту была назначена терапия эверолимусом, внесенным в клинические рекомендации для лечения нейроэндокринных карциноидных опухолей, и паклитакселом — на основании экспрессии молекулярных маркеров в данной опухоли.
Актуальность. Мутации гена CYP21A2 могут приводить к тяжелым формам врожденной дисфункции коры надпочечников (ВДКН) вследствие дефицита 21-гидроксилазы. Большинство мутаций гена — это конверсии между геном CYP21A2 и гомологичным ему псевдогеном CYP21A1P. По данным неонатального скрининга, в РФ распространенность классической формы ВДКН составляет 1:9500. Идентификация мутаций гена CYP21A2 необходима для постановки диагноза и назначения терапии. Целью исследования являлось понимание структуры встречаемости наиболее распространенных мутаций в гене CYP21A2 у пациентов.
Материалы и методы. В исследование было включено 1190 пациентов с подозрением на носительство патогенных вариантов в гене CYP21A2. Этим пациентам было выполнено молекулярно-генетическое исследование на выявление девяти частных мутаций гена CYP21A2 методом ПЦР в реальном времени и/или полное секвенирование гена по Сэнгеру.
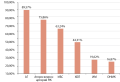
Результаты. Результаты анализа данных показали, что частоты встречаемости вариантов распределились следующим образом: I2spl (rs6467) — 14,96% гетерозигот и 12,52% гомозигот, частота встречаемости минорного аллеля составила 20%; V281L (rs6471) — 17,98% гетерозигот и 7,65% гомозигот, частота встречаемости минорного аллеля составила 16,64%; E3del (rs387906510) — 16,22% гетерозигот и 6,81% гомозигот, частота встречаемости минорного аллеля составила 14,92%; P30L (rs9378251) — 12,69% гетерозигот и 6,39% гомозигот, частота встречаемости минорного аллеля составила 12,73%; I172N (rs6475) — 12,18% гетерозигот и 3,70% гомозигот, частота встречаемости минорного аллеля составила 9,79%; Q318X (rs7755898) — 7,39% гетерозигот и 3,95% гомозигот, частота встречаемости минорного аллеля составила 7,65%; R356W (rs7769409) — 4,62% гетерозигот и 1,43% гомозигот, частота встречаемости минорного аллеля составила 3,74%; кластер Еx6 (rs1554299737, rs12530380, rs6476) — 4,87% гетерозигот и 0,50% гомозигот, частота встречаемости минорного аллеля составила 2,94%; P453S (rs6445) — 2,35% гетерозигот и 0,34% гомозигот, частота встречаемости минорного аллеля составила 1,51%.
Заключение. Мы продемонстрировали статистические данные по частым патогенным мутациям в гене CYP21A2. Наиболее распространенными вариантами, встречающимися более чем в 20% случаев, оказались: I2spl (rs6467) в 27,48%, V281L (rs6471) в 25,63%, E3del (rs387906510) в 23,03%.
Актуальность. Невзирая на достаточно высокую эффективность и безопасность ингибиторов контрольных точек иммунного ответа (ИКТИО), продолжается поиск наиболее доступных биомаркеров, наличие которых можно было бы использовать в качестве предикторов результата противоопухолевого лечения, а также риска возникновения иммуноопосредованных нежелательных явлений (ИОНЯ). Индекс массы тела (ИМТ) был выбран в качестве доступного в реальной клинической практике неинвазивного маркера прогнозирования риска ИОНЯ у пациентов на фоне последующей иммунотерапии ИКТИО.
Материалы и методы. Работа выполнена как сравнительное исследование с одномоментным и ретроспективным компонентами. Набор пациентов осуществлялся в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и ГБУЗ «МГОБ №62 ДЗМ» с января 2020 по февраль 2022 гг. В исследование включено 102 пациента, которым была начата иммунотерапия ИКТИО. При первом поступлении всем проводились измерение роста и массы тела с дальнейшим расчетом ИМТ. На фоне терапии ИКТИО прицельно отслеживались и фиксировались любые ИОНЯ.
Заключение. По нашим данным, согласующимся с имеющимися зарубежными исследованиями, начало ИОНЯ может быть как немедленным, так и отсроченным (описываемые нами ИОНЯ развивались в период от 0 до 34 месяца от момента инициации противоопухолевой иммунотерапии). Так, у 38 пациентов (37,3%) регистрировались разнообразные ИОНЯ, спектр которых был представлен тиреопатиями (n=13, 12,7%), поражениями кожи (n=13, 12,7%), гастроинтестинальной токсичностью (n=7, 6,9%), гепатотоксичностью (n=4, 3,9%), гипофизитами (n=2, 2%), нефритами (n=2, 2%), СД (n=1, 1%), гематологической токсичностью (n=1, 1%), пневмонитом (n=1, 1%), синдромом Гийена-Барре (n=1, 1%). При этом у большинства пациентов встречалось только одно ИОНЯ (n=31, 81,6%), два ИОНЯ выявлялись значимо реже (n=7, 18,4%).
При проведении сравнительного анализа групп пациентов с развившимися ИОНЯ, в том числе дерматологическими, и их отсутствием была получена статистическая тенденция в различии по ИМТ. С помощью ROC-анализа была определена отрезная точка ИМТ, равная 28,16 кг/м2 для всех ИОНЯ, и 25,39 кг/м2 для кожных ИОНЯ, ниже которой, вопреки имеющимся литературным данным, повышался риск развития ИОНЯ. Однако диагностическая чувствительность (ДЧ) и диагностическая специфичность (ДС) оказались невысокими: ДЧ=71% (95% ДИ: 57–83%) и ДС=52% (95% ДИ: 43–59%) для всех ИОНЯ, а для кожных ИОНЯ — ДЧ=77% (95% ДИ: 48–94%) и ДС=62% (95% ДИ: 58–64%). Таким образом, вопрос о взаимосвязи между ИМТ и развитием ИОНЯ остается открытым. Представляется важным осуществление дальнейших исследований с возможной оценкой ИМТ у пациентов с другими (даже более редкими) ИОНЯ, безусловно, с большей выборкой испытуемых.
Актуальность. От 15 до 40% населения России страдают от различных заболеваний щитовидной железы (ЩЖ), при этом от 4 до 6,5% среди всех образований являются злокачественными. Несмотря на такую распространенность, смертность от высокодифференцированного рака (ВДР) ЩЖ крайне низкая и пятилетняя выживаемость при отсутствии отдаленных метастазов составляет более 97%. Ввиду этого на первый план выступает не радикальность выполненной операции, а качество жизни пациента после нее. Одним из методов повышения качества жизни прооперированных пациентов является использование эндоскопических технологий в хирургическом лечении заболеваний ЩЖ.
Материалы и методы. С 2018 по 2023 гг. было выполнено 157 ТАТЭ, 43 пациента были прооперированы по поводу ВДР ЩЖ. Выполнены 21 гемитиреоидэктомия и 22 тиреоидэктомии. Для контроля безрецидивного течения ВДР ЩЖ через 1,5 и каждые последующие 6 мес у пациентов контролировали тиреоглобулин (ТГ) крови и АТ к тиреоглобулину (АТ ТГ), каждые 6 мес после операции выполняли УЗИ щитовидной железы, при необходимости — мультиспиральная компьютерная томография (МСКТ). Для оценки качества жизни в отдаленном послеоперационном периоде было проведено электронное анкетирование пациентов, содержащее 33 вопроса и основанное на индексе оценки качества жизни после тиреоидэктомии (Neck Impairment Dissection Index), индексе нарушения глотания (Swallowing Impairment Index) и индексе нарушения фонации (Voice Handicap Index).
Результаты. Отсутствие локальных признаков рецидива опухоли и нормальный уровень тиреоглобулина (ТГ) (менее 5 нг/мл после тиреоидэктомии и менее 30 нг/мл после гемитиреоидэктомии) было получено у 40 пациентов, что составило 93% и было расценено нами как полный ответ. Биохимически неполный ответ с повышением уровня ТГ и АТ к ТГ был зарегистрирован у 2 пациентов, что составило 4,7%. Структурный неполный ответ через 6 мес после операции был у 1 пациента (2,3%). Неопределенных ответов не было. Пациентам с биохимически и структурно неполным ответом была выполнена радиойодтерапия в послеоперационном периоде. У подавляющего большинства пациентов обеих групп по результатам анкетирования жалоб не было, либо они были минимальными (у 80,3% после эндоскопической операции и у 81,1% после открытой тиреоидэктомии). При оценке комфорта глотания существенной разницы не отмечено. При оценке фонации количество жалоб было больше у пациентов после открытых операций, что свидетельствует о безопасности манипуляций в непосредственной близости от возвратных гортанных нервов при выполнении ТАТЭ. Закономерной и пока нерешенной проблемой является более длительная потеря чувствительности в зоне сепарации тканей области верхнего плечевого пояса после эндоскопических операций, тогда как при традиционных вмешательствах данная область не страдает.
Заключение. Таким образом, полученные результаты позволяют сделать вывод, что эндоскопические трансаксиллярные операции на ЩЖ являются безопасной альтернативой традиционным вмешательствам в том числе при лечении дифференцированного рака ЩЖ.
Актуальность. Рак щитовидной железы (РЩЖ) является наиболее распространенным эндокринным злокачественным образованием с постоянно растущей частотой встречаемости. При различных типах РЩЖ были выявлены множественные молекулярно-генетические и эпигенетические изменения. Существенную роль в патогенезе папиллярного рака щитовидной железы играет мутация BRAFV600E , хромосомные перестройки с участием рецепторных тирозинкиназ RET и TRK (NTRK1), а также мутации в генах малых ГТФаз семейства RAS [1]. Вышеупомянутые изменения считаются взаимоисключающими при дифференцированном раке щитовидной железы [2]. В то же время описаны редкие случаи одновременного присутствия двух и более мутаций в одном и том же опухолевом очаге [3].
Материалы и методы. Мы исследовали 208 парафиновых образцов опухолей ЩЖ на наличие сопутствующих мутаций. Мутации в генах BRAF, KRAS, NRAS изучали методом аллель-специфической ПЦР в режиме реального времени (ПЦР-РВ); транслокации RET/PTС1, RET/PTС3 определяли методом ПЦР-РВ с обратной транскрипцией и использованием TaqMan-зондов.
Результаты. У 46 пациентов была обнаружена одна из мутаций BRAF, KRAS, NRAS, по одному пациенту показали наличие одной из транслокаций. Однако у одного пациента (Ж., 29 лет) в опухоли достоверно выявлялись одновременно две альтерации — NRASQ61K и RET-PTC1, при этом аутентичность ампликона RET-PTC1 была верифицирована секвенированием по Сэнгеру. По данным послеоперационного морфологического исследования, опухоль представляла собой инкапсулированный фолликулярный вариант папиллярного рака ЩЖ (ПРЩЖ) с капсулярной инвазией и единичным фокусом васкулярной инвазии. Данный морфологический фенотип является типичным для RAS-мутантных опухолей. Одновременное выявление транслокации RET-PTC1, характерной для классического варианта ПРЩЖ с инфильтративным характером роста и высоким потенциалом метастазирования в регионарные лимфоузлы, может представлять собой либо неклональное событие, либо свидетельствовать о возможности клональной эволюции опухоли в сторону BRAF-подобного фенотипа.
Заключение. Описан случай одновременного выявления NRASQ61K и RET-PTC1 в фенотипически RAS-подобном ПРЩЖ. Механизмы возникновения и клиническая значимость подобных находок требуют дальнейшего изучения.
Актуальность. Важное значение в возникновении ожирения имеют генетические факторы. Особое место среди них занимает генетический полиморфизм ферментов липидного обмена, к числу которых относится липопротеинлипаза (LPL). Однако до настоящего времени все еще отсутствуют представления о взаимоотношении полиморфизма гена LPL и эндокринной функции мезенхимальных тканей при ожирении. Учитывая это, целью работы стало исследование взаимосвязи полиморфизма LPL (rs328) с изменением уровня адипокинов, миокинов, а также показателей метаболизма липидов в крови у детей и подростков разного пола с ожирением.
Материалы и методы. У 100 здоровых детей и подростков разного пола и 100 их сверстников с ожирением было проведено генетическое исследование по оценке однонуклеотидного полиморфизма гена LPL (rs328). В сыворотке крови спектрофотометрическими методами исследовалось содержание общего холестерола, холестерола ЛПВП, холестерола ЛПНП, холестерола ЛПОНП, триацилглицеролов и активности аминотрансфераз (аланинаминотрансферазы и аспартатаминотрансферазы). Уровень лептина, адипонектина, резистина, апелина, ирисина, адипсина, миостатина, FGF21, остеокрина и онкостатина определялся методом мультиплексного ИФА, а аспросина — иммуноферментным методом.
Результаты. Полиморфизм LPL по rs328 не сопровождается появлением различий в содержании исследованных адипокинов и миокинов в крови здоровых детей и подростков, но вносит существенный вклад в изменение их уровня в крови при ожирении в зависимости от пола. Изменения в содержании исследованных адипокинов и миокинов в крови при ожирении в большей мере проявляются у детей и подростков с генотипом Ser447Ser, чем с генотипом 447Ter. У мальчиков с гомозиготным аллелем Ser447Ser при ожирении в большей мере, чем у девочек, повышается уровень лептина. Содержание адипонектина, апелина и остеокрина в крови у них снижено, по сравнению с таковым у девочек с ожирением с аналогичным генотипом. Гендерные различия у носителей генотипа 447Ter выражены в значительно меньшей мере, чем у носителей гомозиготной аллели Ser447Ser.
Заключение. Характер сдвигов в содержании адипокинов и миокинов в крови у мальчиков с генотипом Ser447Ser указывает на то, что у них в организме ограничивается формирование защитных реакций со стороны обмена веществ при ожирении. Вероятно, это является одной из причин увеличения у них массы жировой ткани, в сравнении с таковой у девочек с ожирением, а также возникновения гиперлипидемии, усиления атерогенеза и альтерации тканей. У девочек с полиморфизмом липопротеинлипазы по rs328 с разными генотипами появляются характерные изменения в уровне адипокинов и миокинов в крови, которые приобретают защитный характер при ожирении. Однако несмотря на это, у девочек-носителей гомозиготного аллеля Ser447Ser при ожирении возникают гиперлипидемия и инсулинорезистентность, не характерные для девочек с генотипом 447Ter. Полученные результаты указывают на важный вклад полиморфизма гена LPL rs328 в изменение уровня адипокинов и миокинов в крови детей и подростков при ожирении в зависимости от их пола. Это необходимо принимать во внимание при лечении ожирения у данного возрастного контингента больных, а также при оценке прогноза течения заболевания и вероятности развития его осложнений.
Актуальность. Сосудистые лейомиосаркомы (СЛ) составляют около 1–2% среди всех мягкотканный сарком. Среди них СЛ, происходящая из нижней полой вены (НПВ), является еще более редкой и встречается ˂ 1 из 100 000 злокачественных новообразований у взрослых. С увеличением числа сообщений об этих случаях в последнее время стал более ясным прогноз, выживание и характеристики этого специфического новообразования. Тем не менее существует много противоречий в отношении оптимального лечения для пациентов с НПВ СЛ. Радикальная резекция с сосудистой реконструкцией или без нее, химиотерапия, радиотерапия и химиорадиотерапия — все эти варианты широко обсуждаются. Мы описываем случай НПВ СЛ у 58-летнего пациента после проведенного оперативного лечения. Пациенты с образованием печени и вовлеченной нижней полой веной имеют негативный результат без оперативного лечения. Согласно PubMed, с 1987 по 2022 гг., представлены более 16 случаев гепатэктомии и реконструкции нижней полой вены.
Материалы и методы. В условиях Павлодарского областного кардиологического центра (ПОКЦ) в 2021 г. была выполнена первичная симультанная операция по удалению опухоли ex viva и моделирование сосудов печени и нижней полой вены в условиях экстремальной гипотермии.
Результаты. Пациентка 58 лет, доставлена в ПОКЦ в плановом порядке с диагнозом: «Первичная саркома нижней полой вены T2bNxMo St III, с восходящим опухолевым тромбом правого предсердия, с вовлечением правой печеночной вены, с тромбозом инфраренального отдела нижней полой вены, синдром Бадда-Киарри, асцит». В ПОКЦ пациентке двумя операционными бригадами выполнено оперативное вмешательство по удалению злокачественного новообразования печени ex vivo и восстановлению магистральных сосудов печени и нижней полой вены in vivo в условиях экстремальной гипотермии до 16 °С и circulatory arrest до 45 минут. Длительность оперативного вмешательства составила 325 минут, ex vivo выполнено удаление образования печени с реконструкцией всех вовлеченных сосудов, искусственное кровообращение составило 164 минуты.
Актуальность. Редкой причиной рецидивирующих гипогликемий у детей является инсулинома — нейроэндокринная опухоль (НЭО), возникающая из бета-клеток поджелудочной железы (ПЖ). Неспецифичность и эпизодический характер симптомов обусловливают позднюю диагностику заболевания с развитием клинически выраженных эпизодов гипогликемий, приводящих к развитию жизнеугрожающих состояний. 10–30% случаев инсулином у детей ассоциированы с синдромом множественных эндокринных неоплазий 1-го типа — МЭН-1, вследствие мутации в гене, кодирующем синтез белка менина. Инсулиномы при данном синдроме характеризуются небольшими размерами (<2 см) и множественным характером, что затрудняет топическую диагностику. ОПИСАНИЕ СЛУЧАЯ. Впервые появление эпизодов слабости, ухудшения общего самочувствия отметили с возраста 8 лет после перенесенного сотрясения головного мозга, в связи с чем наблюдалась неврологом с диагнозом «Соматоформная вегетативная дисфункция нервной системы». В последующем отмечено учащение эпизодов и замечена связь между длительным голодным промежутком и возникновением слабости, контроль гликемии не проводился. В возрасте 13 лет при стационарном обследовании по поводу жалоб на боли в животе выявлены колебания гликемии от 2,0 до 9,5 ммоль/л, дальнейшее обследование не проводилось. В возрасте 16,5 года впервые возник эпизод потери сознания с судорогами на фоне гипогликемии (1,0 ммоль/л). В эндокринологическом отделении на фоне пробы с голоданием подтвержден гиперинсулинемический характер гипогликемий — голодный промежуток 16,5 часа, гликемия 1,9 ммоль/л, иммунореактивный инсулин (ИРИ) 32,1 мкМЕ/мл. С целью дальнейшего обследования пациентка направлена в НМИЦ эндокринологии. При ежедневном контроле гликемии в отделении отмечались эпизоды гипогликемии до 2,8 ммоль/л в утренние часы на фоне длительного голодного промежутка, купировавшиеся приемом пищи. По данным пробы с голоданием подтвержден гиперинсулинемический характер гипогликемий — на фоне гипогликемии (2,5 ммоль/л) выявлено выраженное повышение уровня ИРИ (80 мкЕ/мл), С-пептида (6,32 нг/мл). С целью визуализации инсулиномы проведена МСКТ ОБП с контрастированием: обнаружены множественные гиперваскулярные образования хвоста ПЖ размерами до 12х20х10 мм. В ходе молекулярно-генетического исследования во 2 экзоне гена MEN1 выявлена ранее не описанная делеция одного нуклеотида c.221delG (p.Gly74AlafsTer45) в гетерозиготном положении. Тот же вариант выявлен у отца ребенка, не имеющий клинических проявлений заболевания. Пациентке диагностирован МЭН1-синдром. После предварительной предоперационной подготовки в ДГКБ им. З.А. Башляевой проведена лапароскопическая дистальная резекция ПЖ. Морфологическая картина: высокодиффиренцированная НЭО G1 (менее 2 митозов/2 мм) с низким индексом пролиферативной активности Ki-67 (менее 3%), pT1Nx (на основании макроскопии). Через 6 месяцев при динамическом обследовании в НМИЦ эндокринологии данных за персистенцию органического гиперинсулинизма не получено. Проведен скрининг других компонентов синдрома, по данным МРТ головного мозга — кистозная микроаденома гипофиза (гормонально-неактивная). Рекомендовано продолжить динамическое наблюдение. ВЫВОДЫ. Описанный случай отражает важность своевременной клинической и генетической диагностики инсулиномы у детей, что помогает в выборе оптимального лечения и реализации соответствующей программы наблюдения за пациентами и членами их семьи. КЛЮЧЕВЫЕ СЛОВА: инсулинома; поджелудочная железа; синдромом множественных эндокринных неоплазий 1-го типа>˂ 2 см) и множественным характером, что затрудняет топическую диагностику.
Описание случая. Впервые появление эпизодов слабости, ухудшения общего самочувствия отметили с возраста 8 лет после перенесенного сотрясения головного мозга, в связи с чем наблюдалась неврологом с диагнозом «Соматоформная вегетативная дисфункция нервной системы». В последующем отмечено учащение эпизодов и замечена связь между длительным голодным промежутком и возникновением слабости, контроль гликемии не проводился. В возрасте 13 лет при стационарном обследовании по поводу жалоб на боли в животе выявлены колебания гликемии от 2,0 до 9,5 ммоль/л, дальнейшее обследование не проводилось.
В возрасте 16,5 года впервые возник эпизод потери сознания с судорогами на фоне гипогликемии (1,0 ммоль/л). В эндокринологическом отделении на фоне пробы с голоданием подтвержден гиперинсулинемический характер гипогликемий — голодный промежуток 16,5 часа, гликемия 1,9 ммоль/л, иммунореактивный инсулин (ИРИ) 32,1 мкМЕ/мл. С целью дальнейшего обследования пациентка направлена в НМИЦ эндокринологии.
При ежедневном контроле гликемии в отделении отмечались эпизоды гипогликемии до 2,8 ммоль/л в утренние часы на фоне длительного голодного промежутка, купировавшиеся приемом пищи. По данным пробы с голоданием подтвержден гиперинсулинемический характер гипогликемий — на фоне гипогликемии (2,5 ммоль/л) выявлено выраженное повышение уровня ИРИ (80 мкЕ/мл), С-пептида (6,32 нг/мл).
С целью визуализации инсулиномы проведена МСКТ ОБП с контрастированием: обнаружены множественные гиперваскулярные образования хвоста ПЖ размерами до 12х20х10 мм.
В ходе молекулярно-генетического исследования во 2 экзоне гена MEN1 выявлена ранее не описанная делеция одного нуклеотида c.221delG (p.Gly74AlafsTer45) в гетерозиготном положении. Тот же вариант выявлен у отца ребенка, не имеющий клинических проявлений заболевания. Пациентке диагностирован МЭН1-синдром.
После предварительной предоперационной подготовки в ДГКБ им. З.А. Башляевой проведена лапароскопическая дистальная резекция ПЖ. Морфологическая картина: высокодиффиренцированная НЭО G1 (менее 2 митозов/2 мм) с низким индексом пролиферативной активности Ki-67 (менее 3%), pT1Nx (на основании макроскопии).
Через 6 месяцев при динамическом обследовании в НМИЦ эндокринологии данных за персистенцию органического гиперинсулинизма не получено. Проведен скрининг других компонентов синдрома, по данным МРТ головного мозга — кистозная микроаденома гипофиза (гормонально-неактивная). Рекомендовано продолжить динамическое наблюдение.
Выводы. Описанный случай отражает важность своевременной клинической и генетической диагностики инсулиномы у детей, что помогает в выборе оптимального лечения и реализации соответствующей программы наблюдения за пациентами и членами их семьи.
Актуальность. Адоптивная иммунотерапия с использованием NK-клеток является современным методом лечения онкологических заболеваний. Совместная инкубация NK-клеток с фидерными клетками и цитокинами позволяет получить популяцию, способную эффективно атаковать большой спектр солидных опухолей. Оценка уровня экспрессии молекулярных маркеров CD16, CD38 и HLA-DR на поверхности популяции NK-клеток, полученной в процессе культивирования, позволяет оценить ее активацию.
Методы. Мононуклеарные клетки выделяли из периферической крови 10 пациентов с солидными опухолями на градиенте плотности Ficoll (Sigma-Aldrich) и культивировали в среде RPMI-1640 (Sigma-Aldrich) с добавлением ИЛ-2, ИЛ-15 и ИЛ-21 с фидерными клетками K-562 в течение 14–18 дней. Оценку жизнеспособности клеток проводили с использованием витального красителя 7AAD каждые 7 дней. Анализ экспресии поверхностных маркеров на проточном цитометре Image Stream MkII (Luminex) проводили на 0-й, 7-й и 14-й дни культивирования. Для изучения фенотипа применяли 7-цветную панель меченых антител к СD3/45/56/16/HLA-DR/CD38 (BD Bioscience, Biolegend). Статистическую обработку результатов проводили с использованием парного Т-теста Стьюдента на программном обеспечении MS Excel 2016, результат считался достоверным при р<0,05. Данные приведены в процентах от живых лейкоцитов (СD45+ 7AAD-) в виде среднего арифметического. РЕЗУЛЬТАТЫ. До начала культивирования фенотип лимфоцитов соответствовал референсным значениям, кроме популяции CD3-CD45+CD56+: у 30% пациентов данный показатель был больше нормы. Уровни маркеров HLA-DR и СD38 были менее 5%. На 7-й и 14-й дни культивирования достоверно увечились уровни экспрессии таких маркеров, как CD56, и составили в среднем 69 и 69,3% по сравнению с 15% на 0-й день, а также CD16- 42% на 7-й день, 69% на 14-й день по сравнению с 12,6% на 0-й день. Экспрессия активационных маркеров CD38 и HLA-DR на клетках достоверно увеличилась в 15 раз по сравнению с 0 днем уже на 7-й день и осталась на этом же уровне до 14 дней. Содержание клеток в общей популяции с маркерами CD16, CD38 и HLA-DR на 14-й день было больше, чем содержание на 0-й и 7-й дни. Доля цитотоксических NK-клеток с фенотипом CD56DimСD16+ в общей популяции сохранилась по сравнению с 0 днем, но при этом на этих клетках достоверно увеличилась в несколько раз экспрессия СD38 и HLA-DR. Процентное содержание лимфоцитов с цитокин-продуцирующим фенотипом CD56 BrightCD16- увеличилось в 3 раза по сравнению с 0 днем. Содержание NKT-клеток (CD3+CD56+) на 7-й день составило 3,9%, на 14-й — 5,7%. Жизнеспособность клеток на всех этапах культивирования была на уровне 96% и выше. ЗАКЛЮЧЕНИЕ. В процессе культивирования NK-клеток изменяется их фенотип в сторону активации. Применяемый метод культивации способствует дифференциации NK-клеток в фенотип CD3-CD45+CD56+CD38+HLA-DR+ с высокой способностью к цитолизу. Данную технологию можно применять для получения популяции активированных NK-клеток для проведения адоптивной иммунотерапии. КЛЮЧЕВЫЕ СЛОВА: NK-клетки; адоптивная иммунотерапия; маркер; культивация; фенотип> ˂ 0,05. Данные приведены в процентах от живых лейкоцитов (СD45+ 7AAD-) в виде среднего арифметического.
Результаты. До начала культивирования фенотип лимфоцитов соответствовал референсным значениям, кроме популяции CD3-CD45+CD56+: у 30% пациентов данный показатель был больше нормы. Уровни маркеров HLA-DR и СD38 были менее 5%. На 7-й и 14-й дни культивирования достоверно увечились уровни экспрессии таких маркеров, как CD56, и составили в среднем 69 и 69,3% по сравнению с 15% на 0-й день, а также CD16- 42% на 7-й день, 69% на 14-й день по сравнению с 12,6% на 0-й день. Экспрессия активационных маркеров CD38 и HLA-DR на клетках достоверно увеличилась в 15 раз по сравнению с 0 днем уже на 7-й день и осталась на этом же уровне до 14 дней. Содержание клеток в общей популяции с маркерами CD16, CD38 и HLA-DR на 14-й день было больше, чем содержание на 0-й и 7-й дни. Доля цитотоксических NK-клеток с фенотипом CD56DimСD16+ в общей популяции сохранилась по сравнению с 0 днем, но при этом на этих клетках достоверно увеличилась в несколько раз экспрессия СD38 и HLA-DR. Процентное содержание лимфоцитов с цитокин-продуцирующим фенотипом CD56 BrightCD16- увеличилось в 3 раза по сравнению с 0 днем. Содержание NKT-клеток (CD3+CD56+) на 7-й день составило 3,9%, на 14-й — 5,7%. Жизнеспособность клеток на всех этапах культивирования была на уровне 96% и выше.
Заключение. В процессе культивирования NK-клеток изменяется их фенотип в сторону активации. Применяемый метод культивации способствует дифференциации NK-клеток в фенотип CD3-CD45+CD56+CD38+HLA-DR+ с высокой способностью к цитолизу. Данную технологию можно применять для получения популяции активированных NK-клеток для проведения адоптивной иммунотерапии.
Актуальность. Механизмы канцерогенеза имеют необычайно сложный характер. Множество игроков обуславливают сценарий злокачественной трансформации клеток, опухолевый рост и метастазирование. В последние десятилетия все больше внимания уделяется роли симбиотической человеку микробиоты в регуляции метаболизма и функционирования иммунной системы организма хозяина. В процессе коэволюции участников холоорганизма формировались пути их взаимодействия — “молекулярные диалоги”, а метаболиты микробиоты приобрели особую роль — сигнальных молекул и основных регуляторов таких “диалогов”. Вовлекаясь в сигнальные пути хозяина, бактериальные метаболиты оказались обязательными участниками как физиологических, так и патологических процессов, включая опухолевый рост. Неслучайно состояние дисбиоза и полиморфного микробиома признано одной из ключевых особенностей канцерогенеза. Целью нашего исследования было показать роль метаболитов кишечной микробиоты в инициации, прогрессии и предотвращении опухолевого роста, а также влиянии бактериальных метаболитов на эффективность противоопухолевой терапии.
Методы. Систематический анализ международных баз данных научной литературы по ключевым словам gut microbiota, cancer, cancer therapy, microbiota metabolites, fecal microbiota transplantation.
Результаты. Выступая в качестве мутагенов или сигнальных молекул, аберрантно модулирующих работу сигнальных путей хозяина, микробиотические метаболиты могут инициировать злокачественную трансформацию, способствовать прогрессии роста опухоли и ее метастазированию. С другой стороны, многие метаболиты обладают онкопротективным действием, направляя работу иммунной системы хозяина против опухоли или напрямую стимулируя апоптоз и сенесценцию злокачественно трансформированных клеток. Эффективность противоопухолевой терапии также во многом зависит от состава микробиома, а трансплантация микробиоты рассматривается как один из многообещающих подходов к повышению успеха лечения и выживаемости онкологических пациентов. Однако несмотря на лавинообразное увеличение числа исследований, посвященных роли микробиоты в канцерогенезе, точные механизмы действия микробных метаболитов на организм хозяина остаются непонятными. Мы видим, что некоторые метаболиты (например, бутират) оказывают плейотропные и разнонаправленные эффекты на разные типы клеток, в зависимости от состояния дифференцировки, определенного генетического фона, концентрации самого метаболита. Более того, эффекты таких регуляторных молекул зачастую находятся под влиянием других сигнальных метаболитов, продуцируемых микробиотой, и опухолевого микроокружения.
Заключение. Изучая возможные варианты действия микробных факторов, в перспективе кажется возможным использование модулирующего потенциала таких метаболитов для борьбы со злокачественными опухолями и повышения эффективности лечения.
Актуальность. Таргетные генетические панели — основной инструмент диагностики врожденных патологий в практике врача эндокринолога. Целью их выполнения является установление диагноза и определения оптимальной для конкретного пациента тактики лечения. Секвенирование следующего поколения таргетной генетической панели известных генов, мутации в которых ассоциированны с аденомами гипофиза, акрогигантизмом, многоузловым зобом и другими эндокринными неоплазиями, является инструментом первой линии генетической диагностики, что крайне необходимо для понимания патогенеза, улучшения прогноза и лечения таких пациентов.
Методы. В исследование были включены 77 пациентов в возрасте от 5 до 40 лет. Для пробоподготовки использовалась прошедшая контроль качества геномная ДНК, полученная из образцов периферической крови. Подготовка геномных библиотек производилась согласно протоколу производителя c использованием авторской таргетной панели зондов. Секвенирование готовых библиотек осуществлялось методом массового параллельного секвенирования (next-generation sequencing, NGS) в режиме парно-концевого чтения (2x150п.о.) на платформе Illumina Nextseq 550. Обработка данных секвенирования проведена с использованием автоматизированного алгоритма, включающего выравнивание прочтений на референсную последовательность генома человека (hg38), постобработку выравнивания, идентификацию и фильтрацию вариантов по качеству, а также аннотацию идентифицированных вариантов для всех известных транскриптов каждого гена из базы данных RefSeq.
Результаты. По результатам молекулярно-генетического метода исследования удалось подтвердить диагноз у 32% пациентов (n=25). У 52 пациентов генетическая причина не была выявлена, что в целом согласуется со средней выявляемостью для методик NGS. Патогенные и вероятно патогенные варианты были выявлены в генах DICER1, PTEN, AIP, CHEK2, SDHA и MEN1. Наиболее часто у исследуемой группы пациентов были обнаружены патогенные и вероятно патогенные варианты в гене DICER1 (в том числе одна протяженная делеция), варианты с неопределенной клинической значимостью были выявлены в генах PRKAR1A, APC, CDKN1B. Среди выявленных генетических вариантов 12 были ранее описаны в литературе, а 13 выявлены впервые.
Заключение. Проведение полноэкзомного и полногеномного секвенирования у пациентов без генетических находок по панельному секвенированию с целью поиска мутаций в известных генах и поиск новых генов-кандидатов, варианты в которых могут быть ассоциированны с развитием различных эндокринных новообразований, представляет собой перспективное направление генетических исследований.
АКТУАЛЬНОСТЬ. Рак яичников (РЯ) занимает первое место в структуре смертности среди гинекологических злокачественных новообразований и является гормонозависимой гетерогенной группой опухолей, каждая из которых имеет различия в патогенезе, спектре и частоте мутаций вовлеченных генов, ответе на терапию и прогнозе течения заболевания. У большинства больных диагностируют III–IV стадии заболевания, характеризующиеся неблагоприятным прогнозом. Наибольшая роль в развитии РЯ в настоящее время отводится гормональным и генетическим факторам. Около 26% всех случаев рака яичников обусловлены герминальными мутациями в ключевых генах-кандидатах и в средне- и низкопенетрантных генах, которые в отдельности обуславливают минимальный риск, но из-за мультипликативных и/или кумулятивных эффектов могут приводить к относительно высокому риску для носителей. В связи с чем цель нашего исследования заключается в идентификации редких патогенных вариантов у пациенток с РЯ.
МЕТОДЫ. Материалом для исследования послужили образцы ДНК, выделенные из венозной крови 65 женщин. Массовое параллельное секвенирование ДНК (NGS) проведено на платформе MiSeq (Illumina) с использованием набора реагентов «Соло-тест АВС».
РЕЗУЛЬТАТЫ. Выявлено 6 (9,2%) патогенных вариантов в генах ATM, BRIP1, PPP2R2A, FANCL и RAD51C у 10 (15%) пациенток с серозным типом РЯ. Среди них наибольшее количество патогенных мутаций было идентифицировано в гене PPP2R2A — c.1196G>A (p.Arg399His) у троих пациенток (4,6%). Продукт этого гена принадлежит к семейству регуляторных субъединиц B фосфатазы 2. Протеинфосфатаза 2 является одной из четырех основных Ser/Thr-фосфатаз и участвует в отрицательном контроле роста и деления клеток. По данным литературы, данная мутация ассоциирована с наследственным раком простаты в популяциях восточной Азии. В гене RAD51C были обнаружены мутации c.502A>T (p.Arg168Ter) у двоих пациенток (3%) и c.706-2A>G у одной пациентки (1,5%). Данный ген также входит в число генов гомологичной рекомбинации, которые, как известно, являются супрессорами опухолей. У двоих пациенток был обнаружен патогенный вариант c.507G>A (p.Gln169=) в гене BRIP1 (3%), который нарушает консенсусный сайт сплайсинга и является относительно распространенной причиной аберрантного сплайсинга. Мутации в генах ATM (c.6095G>A(p.Arg2032Lys)) и FANCL (c.1035+1G>C) идентифицированы у двоих пациенток с частотой 1,5% каждая. При мутациях гена АТМ и FANCL снижается количество кодируемого им белка и происходит его инактивация. Это ведет к сбою процессов репарации ДНК, нарушению клеточного цикла, подавлению апоптоза. Помимо этого, у двоих пациенток с серозным РЯ были обнаружены сочетанные варианты мутаций, которые, по данным литературы, приводят к большему риску развития РЯ за счет кумулятивного эффекта. Так, у одной пациентки мутация c.502A>T (p.Arg168Ter) в гене RAD51C была обнаружена совместно с мутацией c.3700_3704del (p.Val1234GlnfsTer8) в гене BRCA1. У другой пациентки мутация в гене BRIP1 c.507G>A (p.Gln169=) выявлена совместно с c.1604A>G(p.Lys535Arg) в гене CHEK2.
ЗАКЛЮЧЕНИЕ. Молекулярно-генетическое исследование 65 женщин с РЯ показало наличие редких герминальных мутаций в генах ATM, BRIP1, PPP2R2A, FANCL и RAD51C (9,2%). Использование метода NGS позволило значительно повысить эффективность поиска мутаций у больных РЯ, доказав наличие широкого спектра редких патогенных мутаций, что может дать фундаментальные знания о патогенезе их опухолей. Эта генетическая оценка может помочь определить потенциальные мишени для конкретных лекарств, например, ингибиторов PARP и алкилирующих агентов, а также для принятия решений о стратегии лечения. Вместе с тем обнаружение редких патогенных мутаций у здоровых женщин может оправдать более интенсивные и персонализированные программы медицинского наблюдения пациенток из групп риска, химиопрофилактические подходы и/или профилактические операции. Помимо этого, особый интерес для дальнейшего исследования представляют комбинации герминальных мутаций для оценки риска развития и уровня патологического эффекта для пациентов с наследственным РЯ.
АКТУАЛЬНОСТЬ. Синдром множественной эндокринной неоплазии 1-го типа (МЭН-1) — синдром Вермера — это наследственная патология наиболее часто характеризуется наличием патологии околощитовидных желез (гиперплазии или аденомы), нейроэндокринной опухолью (НЭО).
ЦЕЛЬ. Продемонстрировать значимость своевременного скрининга и лечения синдрома МЭН-1 для профилактики возможных осложнений и улучшения качества жизни пациентов.
МАТЕРИАЛЫ И МЕТОДЫ, РЕЗУЛЬТАТЫ. Пациентка А., 25 лет, обратилась с жалобами на избыточный вес, нарушение менструального цикла (отсутствие менструаций в течение 3 месяцев), головную боль, общую слабость. В ходе обследования подтвержден клинический синдром множественных эндокринных неоплазий 1 типа: первичный гиперпаратиреоз (ПГПТ): гиперкальциемия — Са скорр. 2,71 ммоль/л (2,15–2,55), нормокальциурия 6,78 ммоль/сут (2,5–8,5) на фоне повышения паратгормона до 116,8 пг/мл (16–65). По результатам методов топической диагностики (УЗИ, cцинтиграфия околощитовидных желез с ОФЭКТ/КТ) подтверждено наличие образования левой нижней околощитовидной железы размерами 2,9х2,2х1,3 см. Ввиду наличия у пациентки в анамнезе пролактин-секретирующей микроаденомы гипофиза, первичного гиперпаратиреоза проведено обследование на предмет компонентов синдрома МЭН-1. По результатам гормональных исследований подтверждено повышение пролактина крови (733,7 мЕд/л) на фоне терапии каберголином 0,25 мг в неделю, данных за наличие других нарушений функций аденогипофиза не получено (ТТГ, ИФР-1, ФСГ, ЛГ, ночной подавляющий тест с 1 мг дексаметазона, кортизол суточной мочи — в пределах нормальных значений). По результатам МРТ головного мозга подтверждено наличие микроаденомы гипофиза размерами 5,5х6,3х5,5 мм с пара(D)селлярным распространением, Knosp I. По данным КТ органов брюшной полости с забрюшинным пространством, выявлены нейроэндокринные образования головки поджелудочной железы размерами 7х6 мм и 7х5 мм. Хромогранин А, гастрин — выше референса. В ходе генетического тестирования панели “Гиперпаратиреоз” в гене MEN1 (NM 130799.2) в 4 экзоне обнаружен ранее описанный в литературе вариант (HG38, chr11:64807677A>G, c.658T>C) в гетерозиготном состоянии, приводящий к аминокислотной замене (p.Trp220Arg) с глубиной покрытия 118х (rs1085307971). Из осложнений выявленных компонентов МЭН-1 по результатам DEXA наблюдалось: снижение МПК ниже значений, ожидаемых по возрасту, в поясничном отделе позвоночника (до -2,0 SD по Z-критерию в L1–L4).
ЗАКЛЮЧЕНИЕ. Таким образом, при диагностике первичного гиперпаратиреоза врач должен исключать синдром МЭН-1. Для его верификации рекомендовано проведение генетического исследования. Пациенты с установленным синдромом МЭН-1 должны находиться под контролем эндокринолога, онколога, проходя регулярный мониторинг состояния.
Актуальность. Иммунотерапия стала перспективной терапевтической стратегией в лечении онкологических заболеваний и дала новые возможности и успехи в борьбе с различного рода опухолями, в том числе с агрессивной меланомой. Одним из направлений иммунотерапии является воздействие на ингибиторы контрольных точек: PD-1, PD-L1, CTLA-4. Уже получены убедительные данные в лечении пациентов, отвечающих на иммунотерапию, целью которой является направить работу иммунной системы, главным образом цитотоксических Т-лимфоцитов, против опухолевого клона. Обнаружение экспрессии PD-L1 на белой и бурой жировой тканях позволяет жировую ткань рассматривать в качестве фактора, содействующего ускользанию опухолевых клеток от иммунного ответа и тем самым увеличивающим вероятность развития онкологических и аутоиммунных заболеваний.
Цель. Изучение уровня PD-L1 и ИЛ-10 у здоровых детей и подростков с ожирением.
Материалы и методы. Обследовано 94 здоровых ребенка и подростка (SDS ИМТ<+1,0) в возрасте 11 [13–15] лет и 86 детей и подростков с экзогенно-конституциональным ожирением I–III степени (SDS ИМТ>+2,0) в возрасте 11 [13–15] лет. Объект исследования — венозная кровь, полученная из локтевой вены. Уровень PD-L1 и ИЛ-17А в сыворотке крови оценивался методом мультиплексного иммуноферментного анализа.
Результаты. Проведенный анализ позволил выявить повышение уровня PD-L1 (р=0,060) у детей и подростков с ожирением, что также сопровождалось статистически значимым увеличением содержания в крови ИЛ-17А (р=0,038). При делении групп по гендерному принципу значимой разницы в содержании PD-L1 и ИЛ-17А не выявлено (p<0,05). ЗАКЛЮЧЕНИЕ. Таким образом, дети с ожирением характеризуется повышенными уровнями PD-L1 и ИЛ-17А, что относит их в группу риска онкологических и аутоиммунных процессов.> ˂ 0,05).
Заключение. Таким образом, дети с ожирением характеризуется повышенными уровнями PD-L1 и ИЛ-17А, что относит их в группу риска онкологических и аутоиммунных процессов.
Актуальность. Лиганд 1 белка программируемой клеточной смерти (PD-L1) играет значительную роль в ускользании опухоли от иммунного ответа. Однако иммуносупрессивное действие PD-L1 связано и с позитивными эффектами: формирование иммунной толерантности кишечной стенки и ее защита от аутоиммунного повреждения, а также ограничение воспаления в жировой ткани при ожирении. Учитывая, что ожирение ассоциировано с вялотекущим системным воспалением, изменением состава кишечного микробиома и проницаемости кишечной стенки, интерес представляет регуляторная роль PD-L1 у пациентов с различными метаболическими фенотипами ожирения.
Материалы и методы. Обследовано 149 здоровых доноров, 70 пациентов с метаболически здоровым ожирением (МЗО) и 84 пациента с метаболически нездоровым ожирением (МНЗО). В крови участников исследования определяли концентрации PD-L1, про- и противовоспалительных цитокинов, а также метаболитов триптофана, представляющих сигнальные молекулы в системе «организм-хозяин — микробиом». Также определяли содержание метаболитов триптофана в кале.
Результаты. Концентрация PD-L1 не различалась у здоровых доноров и пациентов с ожирением вне зависимости от метаболического фенотипа. Однако ожирение сопровождалось изменением взаимосвязей между PD-L1 и цитокинами, PD-L1 и метаболитами триптофана. В контрольной группе наблюдалась слабая ассоциация PD-L1 с IL-10 (rs =0,224, p<0,01) и TNFα (rs =0,222, p=0,01), что демонстрирует роль PD-L1 в поддержании баланса про- и противовоспалительных цитокинов у здоровых доноров. МЗО приводило к появлению положительной связи между PD-L1 и индолами кала: индол-карбоксальдегидом (rs =0,369, p><0,05), индол-ацетатом (rs =0,365, p><0,05) и индол-акрилатом (rs =0,356, p><0,01). Подобное указывает на протективную роль микробиоты в формировании противовоспалительного потенциала кишечника и может быть одним из механизмов снижения кишечной проницаемости, характерной для пациентов с МЗО. У пациентов с МНЗО содержание PD-L1 коррелировало с концентрацией хинолиновой кислоты в кале (rs =0,369, p><0,05) и индол-карбоксальдегида в крови (rs =0,311, p><0,05). Появление ассоциации PD-L1 с уровнем индолов микробного происхождения в крови может указывать на несостоятельность протективного эффекта микробиоты на кишечную стенку и увеличение кишечной проницаемости. ЗАКЛЮЧЕНИЕ. Ожирение связано с появлением ассоциации PD-L1 с содержанием метаболитов кишечной микробиоты в крови и кале. При этом у пациентов с МЗО подобные изменения указывают на протективное действие микробиоты на поддержание иммунной толерантности кишечной стенки, тогда как при МНЗО свидетельствуют об увеличении ее проницаемости. Подобные наблюдения помогают приблизиться к пониманию роли ожирения в развитии онкологических и аутоиммунных патологий. КЛЮЧЕВЫЕ СЛОВА: PD-L1; метаболически здоровое ожирение; метаболически нездоровое ожирение> ˂ 0,01) и TNFα (rs =0,222, p=0,01), что демонстрирует роль PD-L1 в поддержании баланса про- и противовоспалительных цитокинов у здоровых доноров. МЗО приводило к появлению положительной связи между PD-L1 и индолами кала: индол-карбоксальдегидом (rs =0,369, p ˂ 0,05), индол-ацетатом (rs =0,365, p ˂ 0,05) и индол-акрилатом (rs =0,356, p ˂ 0,01). Подобное указывает на протективную роль микробиоты в формировании противовоспалительного потенциала кишечника и может быть одним из механизмов снижения кишечной проницаемости, характерной для пациентов с МЗО. У пациентов с МНЗО содержание PD-L1 коррелировало с концентрацией хинолиновой кислоты в кале (rs =0,369, p ˂ 0,05) и индол-карбоксальдегида в крови (rs =0,311, p ˂ 0,05). Появление ассоциации PD-L1 с уровнем индолов микробного происхождения в крови может указывать на несостоятельность протективного эффекта микробиоты на кишечную стенку и увеличение кишечной проницаемости.
Заключение. Ожирение связано с появлением ассоциации PD-L1 с содержанием метаболитов кишечной микробиоты в крови и кале. При этом у пациентов с МЗО подобные изменения указывают на протективное действие микробиоты на поддержание иммунной толерантности кишечной стенки, тогда как при МНЗО свидетельствуют об увеличении ее проницаемости. Подобные наблюдения помогают приблизиться к пониманию роли ожирения в развитии онкологических и аутоиммунных патологий.
Актуальность. Клинически неактивные («немые») нейроэндокринные опухоли гипофиза — это опухоли передней доли гипофиза, способные синтезировать гормоны, но без симптомов гиперсекреции гормонов с преобладанием признаков масс-эффекта. Составляют 22–54% среди всех нейроэндокринных опухолей гипофиза (НэоГип). Вызывают диагностические сложности у врачей различных специальностей. В соответствии с классификацией ВОЗ опухолей органов эндокринной системы от 2022 г. среди НэоГип выделяют 4 основных клеточных типа опухолей: Pit1-позитивные (из соматотрофных, пролактотрофных и тиреотрофных клеток), Trit-позитивные (из кортикотрофных клеток), SF1-позитивиные (из гонадотрофных клеток) и неопределенного клеточного типа. Среди гормонально-неактивных-опухолей (ГНО) диагностируют все представленные клеточные типы. Определение клеточного типа опухолей является ключевым аспектом для их прогноза. Для диагностики клеточного типа используют широкую панель антител, включающую антитела к гормонам гипофиза (АКТГ, СТГ, ПРЛ, ТТГ, ЛГ и ФСГ), транскрипционным факторам (Pit1, Tpit, SF1), низкомолекулярным цитокератинам, нейроэндокринным маркерам. Такая широкая панель позволяет детально исследовать иммунофенотип гормонально-неактивных опухолей гипофиза. В структуре гормонально-неактивных опухолей преобладают новообразования из гонадотрофных клеток. Определенную проблему представляют ноль-клеточные опухоли без экспрессии гормонов гипофиза, транскрипционных факторов, цитокератинов, что требует проведение тщательной морфологической диагностики и при необходимости дифференциальной диагностики с опухолями нейрогипофиза, селлярными параганглиомами, вторичными опухолями гипофиза. Клинические проявления ГНО имеют широкий спектр от полного отсутствия признаков гормональной активности до слабо выраженных проявлений гиперсекреции гормонов гипофиза. Такой клинической картине соответствует определенный морфологический субстрат. Существуют такие необычные варианты течения ГНО, как двойные опухоли (один из клеточных компонентов может иметь клиническую картину гиперсекреции гормонов гипофиза, второй — нет) или изначально «немые» опухоли могут трансформироваться в гормонально активные (более характерно для кортикотрофных опухолей). Именно определение иммунофенотипа полностью раскрывает особенности указанных новообразований. Перспективными исследованиями по праву считается изучение полного экзома и траснкриптома ГНО.
Таким образом, анализ особенностей клинической картины, морфологического строения и данных молекулярногенетических исследований позволит наиболее подробно изучить столь разнообразные новообразования и выбрать наиболее оптимальную тактику ведения таких пациентов.
Актуальность. В 2020 г. во всем мире было зарегистрировано 604 127 случаев рака шейки матки (РШМ). Основная причина возникновения и развития РШМ — онкогенные штаммы папиломовируса человека (ВПЧ). Однако в 80–90% случаев ВПЧ элиминируется спонтанно в течение 2 лет. Формирование РШМ зависит от генетических и эпигенетических факторов, но его молекулярный патогенез до сих пор не раскрыт. ЦЕЛЬ. Идентификация вероятно патогенных изменений в генах ТР53, MTHFR и F5 среди больных РШМ, проживающих в Республике Башкортостан.
Материалы и методы. Материал — ДНК 108 женщин с клиническим диагнозом «РШМ», выделенная из периферической крови методом фенол-хлороформной экстракции по Mathew (1984). Проведен NGS-анализ с использованием кастомной панели, состоящей из 48 генов, с помощью секвенатора MiSeq Series (Illumina) и набора реагентов MiSeq Reagent Kit v2 (300-циклов) (Illumina). Подготовка библиотек осуществлялась при помощи набора реактивов и методики KAPAHyperCapWorkflowv3.0 (Roshediagnostics) согласно инструкции производителя. Вторичный анализ данных выполнен на базе ресурса Illumina Base Space в приложении «BWA Enrichment» (Illumina). Третичный — с использованием базы данных Variant Interpreter (Illumina).
Результаты. У 87% (94/108) пациентов была выявлена миссенс-мутация в кодоне 72 генаTP53 (c.215C>G, p.Pro72Arg, rs1042522), 45 из них в гомозиготном, 49 — в гетерозиготном состоянии. Мутации гена P53 являются распространенным генетическим событием при большинстве видов рака, и многие такие мутации увеличивают пролиферацию клеток, препятствуют апоптозу и часто приводят к генетической нестабильности. Эффект варианта p.Pro72Arg генаP53 при различных видах рака вызывает споры. Например, Storey A. и его коллеги показали, что вариант белка Arg72 в гомозиготном состоянии может увеличить восприимчивость к раку шейки матки, связанному с ВПЧ, в семь раз. Напротив, Liu G. и его коллеги сообщили, что вариант Pro72 связан с повышенным риском аденокарциномы легких и плоскоклеточного рака. В другом исследовании, проведенном Twu с соавт., сообщалось, что гетерозиготный вариант Arg/Pro связан с повышенным риском плоскоклеточного гипофарингеального рака. У 49% пациентов с РШМ (53/108) был выявлен миссенс-вариант c.665G>A, p.Ala222Val, rs1801133 гена MTHFR, 7 из них в гомозиготном состоянии, 46 — в гетерозиготном. У 53,7% пациентов (58/108) выявлена миссенс-мутация c.1286A>C, p.Glu429Ala, rs1801131 в гене MTHFR, 10 — в гомозиготном состоянии и 48 — в гетерозиготном. Мета-анализ, проведенный WangS. с соавт., предполагает, что варианты rs1801133 и rs1801131 гена MTHFR коррелируют с риском возникновения РШМ. У всех пациентов (100%) была выявлена синонимическая замена p.Arg534= (c.1601T>C) гена F5, причем у 104 — в гомозиготном состоянии и у 4 — в гетерозиготном. В этой же позиции находится вариант rs6025, при котором замена с.1601G>A приводит к миссенс-мутации p.Arg534Gln, широко известной как лейденский вариант фактора V, и вызывает повышенный риск венозной тромбоэмболии. В литературе появилась информация о том, что активация системы свертывания крови связана с более высоким риском инвазии, метастазов и, в конечном итоге, с худшим исходом. Рецептор F5, связанный с белком адгезии G (ADGRF5), участвует в неопластической трансформации некоторых типов рака, например, при колоректальном раке.
Заключение. Полученные результаты вносят вклад в изучение генетической предрасположенности к РШМ, необходимо проведение дальнейших исследований с целью оценки распространенности выявленных изменений в соответствующих популяционных выборках для определения их клинической значимости.
Актуальность. Примерно 10% аденом гипофиза демонстрируют агрессивность, что проявляется быстрым и инвазивным ростом, частыми рецидивами, высоким индексом Ki-67 и резистентностью к традиционным методам лечения. Признаком агрессивности может также быть появление гормональной активности у ранее «немых» аденом гипофиза, что также должно обратить на себя внимание клинициста.
Описание случая. Пациентке И., 43 лет, в 2014 г. проведено транссепто-транссфеноидальное удаление макроаденомы гипофиза с эндо-, супра-, латероселлярным распространением размерами 19,2х18,6х15,6 мм. Гормональная активность аденомы до хирургического лечения не исследовалась, по результатам послеоперационного патоморфологического исследования диагностирована эозинофильная аденома гипофиза. В дальнейшем на динамическом наблюдении у эндокринолога пациентка не состояла. Впервые повышение ИФР-1 до 357 нг/мл (82–279) отмечено в 2015 году.
В 2023 г. госпитализирована в ФГБУ «НМИЦ эндокринологии», где при проведении МРТ головного мозга отмечен продолженный рост аденомы гипофиза: в полости деформированного турецкого седла визуализировано образование размерами 31,5х20х15,5 мм с эндо-, инфра-, супра-, латеро- (D, knosp IV), с выраженным антеселлярным распространением. В ходе гормонального исследования крови у пациентки была подтверждена акромегалия: ИФР-1 624,2 нг/мл (51–271), СТГ 6,82 нг/мл (0,06–6,9). Пациентке проведена трансназальная транссфеноидальная аденомэктомия (ТНАЭ) с удалением части опухоли ввиду невозможности радикального удаления латероселлярного и антеселлярных компонентов, по данным патоморфологического исследования диагностирована хромофобная аденома гипофиза. При иммуногистохимическом исследовании в опухолевых клетках обнаружено слабо выраженное окрашивание цитоплазмы опухолевых клеток с антителами к СТГ, индекс метки Ki-67=2,2%, а также умеренно выраженная экспрессия рецепторов соматостатина 2 и 5 подтипов на мембране до 80% опухолевых клеток - нейроэндокринная редкогранулированная соматотрофная опухоль гипофиза. В раннем послеоперационном периоде подавления уровня СТГ в ходе орального глюкозотолерантного теста получено не было: СТГ 0 мин — 3,85 нг/мл, СТГ +30 мин — 3,67 нг/мл, СТГ +60 мин — 3,01 нг/мл, СТГ +90 мин — 2,41 нг/мл, СТГ +120 мин — 2,29 нг/мл.
При выписке пациентке рекомендована терапия пролонгированными аналогами соматостатина и консультация нейрорадиолога с целью решения вопроса о необходимости проведения лучевой терапии.
Заключение. Представленный клинический случай отражает важность проведения первичного гормонального и иммуногистохимического исследований после хирургического лечения для определения тактики ведения пациента, а также изучения механизмов, приводящих к агрессивности аденом гипофиза, в т.ч. с изменением патоморфологических характеристик опухоли.
Актуальность. Паратиреоидная карцинома (ПК) — редкое злокачественное заболевание одной или нескольких околощитовидных желез (ОЩЖ). Пациенты с опухолями ОЩЖ характеризуются повышенным образованием и выделением паратгормона (ПТГ), вследствие чего у них развивается высокий уровень гиперкальциемии и множественные осложнения. ПК характеризуется тяжелым течением и высокой частотой рецидивов (23–51%) после лечения, золотым стандартом которого остается хирургическое вмешательство «единым блоком». Лечение рецидивов также хирургическое, т.к. чаще всего ПК радио- и химиорезистентна. Большой интерес представляют подходы генной и иммунной терапии ПК. Однако к настоящему времени известны только единичные попытки иммунотерапии ПК, основанные на иммунизации синтетическими пептидами ПТГ человека и использовании дендритных клеток пациента. Эти подходы не всегда были эффективны, оставляя актуальным вопрос разработки генотерапевтической вакцины.
Материалы и методы. Мы создали вакцину на основе аденоассоциированного вирусного (AAV) вектора в двух вариантах — с участком, кодирующим мышиный паратгормон (AAV-мПТГ), и с участком, кодирующим еще мембранный якорь GPI, оставляя экспрессирующийся мПТГ заякоренным в мембране клеток (AAV-mПТГ-GPI). Вакцина была введена мышам линии C57BL/6 внутримышечно. Животные были разбиты на 3 группы по 5 в каждой. Первая группа была контрольная, вторая группа была вакцинирована конструкцией мПТГ, а третья группа — конструкцией мПТГ-GPI. Титр вируса составлял 1*10^11, серотип — AAV2. Через 2 недели была проведена бустерная вакцинация в тех же дозах. Серотип — AAV9. Животные были выведены из эксперимента через 6 недель после введения бустера. Субпопуляционный состав спленоцитов мышей анализировали с помощью проточной цитометрии на клеточном сортере BD FACS Aria III. Способность вакцины вызывать специфический ответ оценивали с помощью IFN-γ ELISpot и теста на пролиферативную активность спленоцитов (после специфического воздействия (пулом пептидов к мышиному ПТГ) и неспецифического воздействия (частицы анти-CD3/CD28)) по CFSE-сигналу, измеряемому с помощью проточной цитометрии. Пул пептидов ПТГ был выбран на основе предсказания их связывания с молекулой МНС I in silico.
Результаты. Спленоциты мышей, вакцинированных конструкцией мПТГ-GPI, делились медленнее в ответ на неспецифический стимул Т-кл.рецептора. К 3-му дню отмечалось 49,7% +/- 14,1 поделившихся клеток, тогда как в группе невакцинированных мышей — 79,1 +/- 8,2, а в группе спленоцитов мышей, вакцинированных конструкцией мПТГ, — 74,8 +/- 17,43. Также в группе мышей после вакцинации мПТГ-GPI среди спленоцитов отмечался повышенный уровень активированных CD4+CD25+ T-клеток и тренд к увеличению количества регуляторных Т-клеток. Специфический стимул (пул пептидов к мПТГ в двух разных концентрациях) не привел к изменению продукции IFNg ни в одной из двух экспериментальных группах.
Заключение. Мы не обнаружили специфический иммунный ответ на трансген мПТГ. Существует множество факторов, влияющих на иммуногенность трансгена, доставляемого с помощью AAV-векторов. Магнитуда иммунного ответа критичным образом зависит от протокола. Однако мы увидели замедление деления спленоцитов мышей после вакцинации мПТГ-GPI в ответ на неспецифический стимул Т-клеточного рецептора. Мы предполагаем, что это замедление может быть связано с повышением порога активации Т-клеток, что кажется естественным на фоне повторяющейся стимуляции дендритных клеток антигеном мПТГ, который остался на мембране вакцинированных клеток. Этот антиген может оказаться слабым для инициации созревания ДК и индукции полноценного иммунного ответа к мПТГ, но способным вызывать индукцию толерантности к этому антигену.
Актуальность. NK-клетки, или естественные киллеры, занимают промежуточное положение между врожденным и адаптивным иммунитетом, регулируя иммунный ответ за счет своих цитолитических свойств и способности продуцировать разнообразные цитокины. Участие NK-клеток в иммунопатогенезе аутоиммунных заболеваний бесспорно, но к настоящему времени их роль до конца не раскрыта и остается противоречивой. Данное исследование направлено на разработку методических подходов и стратегии анализа субпопуляций NK-клеток в качестве прогностических и предиктивных маркеров эффективности терапии и прогноза течения у пациентов с сахарным диабетом 1-го типа.
Материалы и методы. Мы разработали многоцветные панели для проточной цитометрии с целью анализа субпопуляций NK-клеток в периферической крови пациентов с сахарным диабетом 1-го типа у детей и взрослых. Проанализировано 65 детей и 12 взрослых пациентов. Анализ проводили на проточном цитометре LSRFortessa (BD Bioscience, США) с ПО Diva. В каждом образце анализировали 5000 событий в целевом гейте лимфоцитов. Использовали моноклональные антитела к следующим антигенам: CD3, CD19, CD16, CD56, CD8, CD4, CD161, TCR Va24-Ja18, TCR Va7.2-Jα33, CD38, EOMES, NKG2A, PD-1, LAG-3, TIM-3, TIGIT, CD95. Измеряли следующие субпопуляции NK-клеток: тотальные NK-клетки, регуляторные NK-клетки, цитокин-продуцирующие NK-клетки, промежуточные NK-клетки, эффекторные NK-клетки, цитолитические NK-клетки, незрелые NK-клетки. Также субпопуляции NK-T-клеток, в том iNKT и ассоциированные со слизистой оболочкой инвариантные Т-клетки, MAIT. Во всех субпопуляциях NK- и NK-T-клеток оценивали ко-экспрессию активационных CD38, EOMES и ингибирующих молекул — CD161, NKG2A. Регуляторный статус устанавливали по экспрессии контрольных точек иммунитета: PD-1, LAG-3, TIM-3, TIGIT. Цитотоксический потенциал оценивали по продукции гранзима В и перфорина. Статистический анализ проводили с использованием программы GraphPadPrism 8 (GraphPad Software, США).
Результаты. Разработаны многоцветные панели для проточной цитометрии и предложены стратегии многоступенчатого гейтирования субпопуляций NK- и NK-Т-клеток в периферической крови. Получены данные по частоте встречаемости в периферической крови мажорных и минорных субпопуляций NK- и NK-Т-клеток в периферической крови пациентов с сахарным диабетом 1-го типа у детей и взрослых. Выявлены закономерности экспрессии функциональных маркеров. Определены корреляционные зависимости между частотой различных субпопуляций с различным функциональным статусом и стажем заболевания, осложнениями в виде кетоацидоза, уровнем аутоантител, количеством С-пептида.
Заключение. На данном этапе исследования показана зависимость клинических и иммунологических показателей у больных сахарным диабетом 1-го типа. В зависимости от стадии заболевания и взаимодействия с другими иммунными клетками, NK-клетки, обладающие цитотоксическими и регуляторными свойствами, могут являться обоюдоострым звеном иммунной системы, вызывая противоположное действие. Установленные закономерности, безусловно, требуют подтверждения бо́льшим количеством наблюдений.
Актуальность. Случайно выявленные образования поджелудочной железы (ПЖЖ) считаются редкой находкой c частотой встречаемости in vivo менее 1%. Изолированное метастазирование в ПЖЖ встречается крайнее редко и составляет 2–5% всех злокачественных новообразований ПЖЖ, метастазирование меланом в ПЖЖ составляет и вовсе <1%. Метастазы в ПЖЖ могут напоминать первичные злокачественные новообразования, такие как потоковая карцинома или нейроэндокринные опухоли. Здесь мы представляем уникальный случай злокачественной меланомы с изолированным метастазированием в ПЖЖ. ОПИСАНИЕ СЛУЧАЯ. Пациент Р., 65 лет, из анамнеза известно, что в 2010 г. был установлен диагноз «Меланома кожи туловища» рТхN0M0, было проведено широкое иссечение меланомы кожи с последующей иммунотерапией «Интерферон» в 2010–2011 гг. Тогда же был установлен диагноз «Сахарный диабета 2 типа», находился на пероральных сахароснижающих препаратах. С сентября 2021 г. стал отмечать снижение уровня гликемии ><3 ммоль/л, сопровождающееся потливостью, дрожью в теле, сердцебиением и чувством голода, которое купировалось приемом быстроусвояемых углеводов. При обследовании, по данным УЗИ органов брюшной полости, было выявлено образование головки ПЖЖ. По данным МСКТ, образование ПЖЖ округло-овальной формы, с четкими контурами, накапливающее контраст, размерами 21х17х16 мм. Была проведена 36-часовая проба с голоданием, по итогам которой данных за наличие инсулиномы получено не было (гликемия 2,8 ммоль/л, инсулин 1,9 мкМЕ/мл (2,6–24,9), С-пептид 220 пмоль/л (260–1730). Онкомаркеры СА19-9, РЭА, хромогранин А-в пределах нормы. Дважды была выполнена эндоскопическая биопсия образования ПЖЖ под УЗИ-контролем: информативных данных о характере неоплазии не получено. Через 6 месяцев при динамическом обследовании была отмечена отрицательная динамика, размеры образования, по данным МСКТ, увеличились до 27х21х20 мм, было рекомендовано проведение хирургического лечения, однако на тот момент пациент от предложенного лечения воздержался. По данным МСКТ, еще через 6 месяцев образование увеличилось до 38х26х31 мм. Была проведена гастропанкреатодуоденальная резекция. По данным гистологического исследования, определялось разрастание опухоли солидного строения с большим количеством митозов (>˂ 1%. Метастазы в ПЖЖ могут напоминать первичные злокачественные новообразования, такие как потоковая карцинома или нейроэндокринные опухоли. Здесь мы представляем уникальный случай злокачественной меланомы с изолированным метастазированием в ПЖЖ.
Описание случая. Пациент Р., 65 лет, из анамнеза известно, что в 2010 г. был установлен диагноз «Меланома кожи туловища» рТхN0M0, было проведено широкое иссечение меланомы кожи с последующей иммунотерапией «Интерферон» в 2010–2011 гг. Тогда же был установлен диагноз «Сахарный диабета 2 типа», находился на пероральных сахароснижающих препаратах. С сентября 2021 г. стал отмечать снижение уровня гликемии ˂ 3 ммоль/л, сопровождающееся потливостью, дрожью в теле, сердцебиением и чувством голода, которое купировалось приемом быстроусвояемых углеводов. При обследовании, по данным УЗИ органов брюшной полости, было выявлено образование головки ПЖЖ. По данным МСКТ, образование ПЖЖ округло-овальной формы, с четкими контурами, накапливающее контраст, размерами 21х17х16 мм. Была проведена 36-часовая проба с голоданием, по итогам которой данных за наличие инсулиномы получено не было (гликемия 2,8 ммоль/л, инсулин 1,9 мкМЕ/мл (2,6–24,9), С-пептид 220 пмоль/л (260–1730). Онкомаркеры СА19-9, РЭА, хромогранин А-в пределах нормы. Дважды была выполнена эндоскопическая биопсия образования ПЖЖ под УЗИ-контролем: информативных данных о характере неоплазии не получено. Через 6 месяцев при динамическом обследовании была отмечена отрицательная динамика, размеры образования, по данным МСКТ, увеличились до 27х21х20 мм, было рекомендовано проведение хирургического лечения, однако на тот момент пациент от предложенного лечения воздержался. По данным МСКТ, еще через 6 месяцев образование увеличилось до 38х26х31 мм. Была проведена гастропанкреатодуоденальная резекция. По данным гистологического исследования, определялось разрастание опухоли солидного строения с большим количеством митозов (>20 на 10РПЗ). Для определения гистогенеза опухоли выполнено ИГХ-исследование: клетки опухоли интенсивно экспрессировали Мелан А и S100, отсутствовала экспрессия хромогранина А, цитокератинов 5/6,19, ЭМА, средний индекс Ki67=45%. Таким образом, при помощи патоморфологического исследования образование было верифицировано как метастаз эпителиоидно-клеточной беспигментной меланомы в ПЖЖ. В настоящий момент пациент проходит дополнительное обследование для исключения множественного метастатического процесса меланомы.
Заключение. Данный клинический случай демонстрирует сложность верификации диагноза на всех этапах лечения и необходимость мультидисциплинарного подхода при образованиях ПЖЖ.
Актуальность. Феохромоцитомы (ФХЦ), или надпочечниковые параганглиомы, — нейроэндокринные опухоли, происходящие из клеток мозгового вещества надпочечников и продуцирующие катехоламины (адреналин, норадреналин, дофамин). Большинство пациентов с ФХЦ можно отнести к 2 типу молекулярно-генетическому кластеру опухолей (киназно-сигнальному), который характеризуется преимущественно адренергическим фенотипом и ассоциирован с кризовым течением артериальной гипертензии (АГ). Повышенный уровень катехоламинов определяет широкий спектр неврологических, метаболических и кардиоваскулярных проявлений, что в некоторых случаях может затруднять раннюю диагностику заболевания.
Материалы и методы. Мы проанализировали данные с 2011 по 2023 гг., 92 пациента с гистологически и иммуногистохимически верифицированным диагнозом ФХЦ, из них 60 женщин и 32 мужчины в возрасте от 22 до 88 лет (медиана — 50 лет).
Результаты. По данным КТ, объем ФХЦ варьировал от 4,72 см3 до 2070 см3 (медиана 86,4 см3), нативная плотность ФХЦ от +9 HU до +96 HU (медиана +41 HU).
Наиболее часто встречающимся симптомом была АГ, которая отмечалась у 88 пациентов (95,65%), среди них у 69 человек (78,4%) наблюдалось кризовое течение АГ и у 12 пациентов (13,6%) — постоянная форма АГ. Медиана артериального давления (АД) составила 200/125 мм рт. ст. Эпизоды тахикардии наблюдались у 36 пациентов (39%). Среди других наиболее частых симптомов оказалась головная боль, которая отмечалась у 49 больных (53%), боли в поясничной области у 22 пациентов (24%) и потливость — у 17 (18%). Чувство тревоги, тошнота, побледнение или покраснение лица встречались гораздо реже.
По данным лабораторного обследования, преобладал смешанный тип секреции, т. е. повышение секреции и адреналина, и норадреналина (45 пациентов, 49% случаев), у 18 пациентов (20%) оказался норадреналиновый тип секреции, редко встречался адреналиновый (6 пациентов, 7%). Интересно, что у 10 (11%) пациентов не отмечалось повышение секреции катехоламинов, несмотря на верифицированную в дальнейшем ФХЦ. Возможно, у них имелся дофаминовый тип секреции, который в настоящее время в рутинной клинической практике не доступен для определения по техническим причинам.
Заключение. В нашем исследовании у большинства пациентов с предположительной принадлежностью ко 2 молекулярно-генетическому кластеру преобладал именно смешанный тип секреции катехоламинов, а кризовое течение АГ встречалось не во всех случаях. Полученные результаты формируют новый взгляд на взаимосвязь молекулярно-генетического кластера и клинико-биохимического фенотипа. Отсутствие секреции катехоламинов не исключает наличие феохромоцитомы у больных с артериальной гипертензией и опухолью надпочечников с высокой нативной плотностью, что необходимо учитывать при выборе антигипертензивной терапии и/или предоперационной подготовке.
Актуальность. Нарастающая распространенность дисфункции щитовидной железы, вызванной йодсодержащими контрастными веществами (ЙКВ), связана с необходимостью визуализации сосудистого русла в ургентной кардиологии, сердечно-сосудистой хирургии, онкологии и др. Проведение компьютерной томографии с ЙКВ входит в стандарт диагностики большинства злокачественных опухолей для уточнения топографо-анатомических взаимоотношений первичной неоплазии, верификации клинической стадии — обнаружения регионарных или отдаленных метастазов, выявления рецидивов или прогрессирования при выполнении исследования в динамике. При увеличении количества исследований частота йодиндуцированного нарушения функции щитовидной железы нарастает, достигая 15%. Несмотря на значимую роль тиреоидного статуса в регуляции работы сердечно-сосудистой системы, его исходная и динамическая оценка в процессе противоопухолевого, в том числе полихимиотерапевтического лечения, не является обязательной. Не исключено, что изменение функции щитовидной железы под действием ЙКВ может служить важным способствующим фактором клинической реализации кардиоваскулярной токсичности полихимиотерапии.
Цель. Оценка тиреоидного статуса больных, госпитализированных в химиотерапевтическое отделение, для проведения первого курса полихимиотерапии по поводу рака желудка или толстой кишки.
Материалы и методы. Проведено одномоментное когортное исследование 110 пациентов с раком желудка и толстой кишки. Средний возраст пациентов составил 62±16,97 лет, из них 59 мужчин (53,6%), 51 женщина (46,4%). Забор крови осуществлялся утром, перед введением препаратов первого курса полихимиотерапии, что соответствовало двум-трем неделям после выполнения компьютерной томографии с ЙКВ. Тиреотропный (ТТГ) и тиреоидный гормоны (Т4 свободный (Т4св), Т4 общий (Т4общ), Т3 свободный (Т3св), Т3 общий (Т3общ)) определены методом иммуноферментного анализа на 6-планшетном анализаторе «ALISEI Q.S.», Италия. Использованы реактивы производителя АО «Вектор-Бест», РФ. Референсные значения ТТГ составили 0,3–4,0 мМЕ/л, Т4св — 10,0–25,0 пмоль/л, Т4общ — 60,0–160,0 нмоль/л, Т3св — 3,8–6,0 пмоль/л, Т3общ — 1,2–3,0 нмоль/л. Статистическую обработку полученных данных проводили с помощью программы Exel Starter. Результаты оценки тиреоидного статуса представлены в виде медианы и интерквартильного размаха [Q25%–Q75%].
Результаты. Проведенный анализ результатов верифицировал эутиреодное состояние у 84 (76,4%) человек. Концентрация ТТГ у этой группы больных составила 0,98 мМЕ/л [0,75–1,65], Т4св 13,56 пкмоль/л [11,86–16,18], Т4общ 140,41 нмоль/л [97,27–184,17], Т3св 4,37 пкмоль/л [3,38–4,95], Т3 общ 2,0 нмоль/л [1,70–2,64]. Тиреоидный статус у 26 (23,6%) пациентов характеризовался отклонениями. Субклинический гипотиреоз выявлен у 2 (1,8%) больных, манифестный гипотиреоз — у 7 (6,4%) пациентов. В группе гипотиреоза ТТГ составил 5,06 мМЕ/л [4,93–7,39], Т4св — 10,17 пкмоль/л [9,16–12,44], Т4общ — 142,17 нмоль/л [118,61–165,28], Т3св — 4,53 пкмоль/л [4,06–5,30], Т3 общ — 1,85 нмоль/л [1,38–3,22]. Субклинический гипертиреоз диагностирован у 17 (15,4%) пациентов, клинических наблюдений тиреотоксикоза не выявлено. В группе гипертиреоза показатели гормонов составили: ТТГ — 0,24 мМЕ/л [0,06–0,29], Т4св — 16,13 пкмоль/л [12,03–17,13], Т4общ — 158,93 нмоль/л [111,97–183,53], Т3св — 4,64 пкмоль/л [4,37–5,12], Т3 общ — 1,97 нмоль/л [1,82–2,33].
Заключение. Учитывая факторы риска (пожилой возраст пациентов, наличие сопутствующей сердечно-сосудистой патологии), актуальным представляется вопрос о возможном потенциировании кардиоваскулярной токсичности, ассоциированной с проведением химиотерапии, дистиреозом, а также влиянии изменений тиреоидного статуса на течение онкологического заболевания и прогноз подобных больных, что требует дальнейшего изучения.
Актуальность. Морфологическая диагностика новообразований щитовидной железы (ЩЖ) вызывает значительные трудности, что обусловлено субъективностью применяемых критериев, несовершенством классификаций, а также отсутствием единого подхода при вырезке операционного материала. На сегодняшний день необходим поиск новых решений, позволяющих повысить точность диагностики опухолей ЩЖ, оптимизировать временные затраты врача-патоморфолога, а также снизить сроки предоставления гистологического заключения. Применение искусственного интеллекта в разных сферах деятельности может позволить не только автоматизировать анализ гистологических препаратов опухолей ЩЖ, но и, возможно, выявить новые диагностические и прогностические критерии.
Материалы и методы. В исследование включено 966 пациентов (966 снимков), которым была проведена геми-/тиреоидэктомия в ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России. В эксперименте участвовали случаи, в которых был определен один из двух диагнозов: доброкачественное или злокачественное новообразование ЩЖ. Классификация слайдов выполнялась с помощью метода Attention-MIL (Multiple-Instance Learning), позволяющего обрабатывать изображения гигапиксельного разрешения по частям, при этом используя только высокоуровневую разметку данных (без указания характерных областей интереса на изображении). В качестве архитектуры модели принятия решений использовалась искусственная нейронная сеть CLAM, для вычисления признаковых представлений сканов использовалась предварительно обученная нейросетевая модель CTransPath. Исходная выборка была разделена на обучающую и валидационную в соотношении 4:1, соответственно.
Результаты. На данный момент проведены несколько серий экспериментов по классификации слайдов с использованием только высокоуровневой разметки. Для оценки качества классификации была выбрана метрика ROC-AUC, поскольку она более информативна в случае несбалансированных выборок, а также для ее расчета не требуется подбирать порог для предсказанной моделью уверенности. В лучшем на данный момент эксперименте удалось достичь значения ROC-AUC=0,944 на валидационной выборке данных (193 слайда из 966). Кроме того, использованный метод позволяет выполнять визуализацию областей, внесших наибольший вклад в принятие решения моделью. По итогам обсуждения полученных данных врачами-патоморфологами было выявлено, что в большинстве случаев области, помеченные моделью как «важные», действительно являются таковыми. Однако были обнаружены и признаки переобучения модели на некоторые характерные детали изображений, проявляющиеся в редких случаях.
Заключение. Успешно подтверждена эффективность применения схемы Attention-MIL, разработан прототип инструмента визуализации, который поможет в детальном анализе и обосновании полученных результатов. Следующими этапами является расширение набора классов для решения задачи классификации, а также добавление дополнительных целевых переменных, отражающих важные факторы при постановке диагноза.
Актуальность. Нейроэндокринные опухоли (НЭО) прямой кишки — редкие новообразования, развивающиеся из нейроэндокринных клеток эмбриональной ткани — апудоцитов, продуцирующие глюкагон-подобный пептид. Точные статистические данные по распространенности НЭО прямой кишки в Российский Федерации отсутствуют. По данным международной литературы, НЭО прямой кишки составляют 0,4% от всех колоректальных опухолей. Ежегодно выявляемость НЭО прямой кишки составляет 0,76 случаев на 100 000 населения.
Материалы и методы. Проведен анализ пациентов с НЭО прямой кишки за период с 2015 по 2023 гг., находившихся на лечении в МКНЦ им. А.С. Логинова. Всего проанализировано 12 пациентов. Из них мужчин — 4 (33,3%), женщин — 8 (66,7%). Средний возраст при постановке диагноза составлял 52,4 года. При подозрении на опухолевую патологию выполнялся стандартный алгоритм диагностических мероприятий, включающий в себя ФКС с биопсией очага поражения. Для определения метастатического поражения использовалось КТ и/или МРТ в сочетание с ПЭТ-КТ. Лабораторная диагностика заключалась в определении маркеров НЭО (хромогранин А, серотонин, нейронспецифическая енолаза).
Результаты. ТЭМ удаление НЭО прямой кишки выполнено у 12 (100%) пациентов. По данным предоперационного обследования, у всех 12 пациентов наблюдалась инвазия в пределах подслизистого слоя стенки прямой кишки и отсутствовали признаки поражения регионарных лимфатических узлов. По данным предоперационного КТ, отдаленные метастазы отсутствовали в 100% наблюдений. У 8 (66,6%) пациентов опухоль локализовалась в среднеампулярном отделе прямой кишки, в нижнеампулярном отделе у 4 (33,4%) пациентов. Средний размер опухоли — от 2 до 7 мм,а среднее расстояние опухоли от наружного края анального канала составило от 4 до 11 см. Послеоперационных осложнений не было. Средний послеоперационный койко-день составил 7 дней. По результатам патоморфологического исследования: у 7 (58,3%) пациентов установлена стадия рТ1а, у 3 (25%) пациентов pT1b, у 2 (16,7%) пациентов рТ2. По степени злокачественности опухоль G1 определялась у 10 (83,3%) пациентов, G2 — у 2 (16,7%) пациентов. Все операции были выполнены в радикальном объеме (R0). У всех 12 больных инвазия опухоли была ограничена подслизистым слоем. Отдаленные результаты лечения прослежены у всех 12 (100%) пациентов. Среднее время наблюдения за пациентами составило 42 месяца (от 11 до 100 месяцев). Прогрессирование заболевание отмечено у 2 из 12 пациентов. У одного пациента с НЭО G1 размером 11 мм через 8 месяцев и у одного пациента с НЭО G1 и размером 10 мм через 7 месяцев возник логорегиональный рецидив в параректальном лимфатическом узле, в связи с чем им была выполнена передняя резекция прямой кишки. При патоморфологическом исследовании в 1 из 14 исследованных лимфатических узлов выявлен метастаз НЭО. В настоящее время у пациентов признаков возврата заболевания не выявлено. Таким образом, частота локорегионального рецидива НЭО после ТЭМ составила 2/12 — 16,6%. Все случаи возврата заболевания были выявлены у пациентов с крупными НЭО прямой кишки размером более 10 мм.
Заключение. НЭО прямой кишки — редкая патология, которая требует мультидисплинарного подхода. Чаще всего протекает асимптомно, большинство из них представляют собой локализованные опухоли небольших размеров. При размере опухоли менее 1 см прогноз благоприятный. На сегодняшний день золотым стандартом лечения НЭО прямой кишки является хирургический, однако требуется более длительный период наблюдения и большая величина когорты для формирования окончательной позиции.
Актуальность. Общая заболеваемость нейроэндокринными опухолями (НЭО) неуклонно растет в течение последних десятилетий. Это связано в первую очередь с повышением доступности высококачественных методов диагностики.
Материалы и методы. Проведен анализ пациентов с НЭО различной локализации из регистра МКНЦ им. А.С. Логинова. Под наблюдением находились все больные с 2015 по 2023 годы, обратившиеся за помощью и получивших лечение за указанный период. РЕЗУЛЬТАТЫ. В настоящее время в МКНЦ им. А.С. Логинова наблюдаются 655 пациентов с нейроэндокринными опухолями (НЭО) различной локализации, среди которых 445 женщин (68%) и 210 мужчин (32%). Медиана возраста составила 54,5 года. Средний период наблюдения составляет 38 месяцев (от 4 до 74). Чаще всего НЭО локализуются в желудочно-кишечном тракте — 571 пациент (87%). Самой частой локализацией вне желудочно-кишечного тракта являются трахея и легкие — 21 пациент (3%). Применение доступного арсенала методов инструментальной диагностики не позволило установить локализацию первичной НЭО у 30 (4,6%) пациентов. 277 пациентов (42%) получили хирургическое лечение, 136 пациентов (21%) получают системную терапию, к этой группе относятся пациенты с распространенным процессом и наличием противопоказаний к проведению радикального хирургического лечения. Большинство НЭО в желудочно-кишечном тракте локализовались в поджелудочной железе — 259 пациентов (45% желудочно-кишечных НЭО), на 2 месте желудок — 184 пациента (32%) и на 3 месте тонкая кишка — 61 пациент (11%). Значительно реже НЭО выявлялись в других отделах ЖКТ: двенадцатиперстной кишке — 31 (5%) больных, толстой и прямой кишке — 28 (5%) больных, червеобразном отростке — 8 (2%) больных. Среди НЭО желудка преобладает 1 тип по ВОЗ — 153 пациента, 2 тип — 12 пациентов, 3 тип — 19 пациентов. Среди НЭО поджелудочной железы у 93 пациентов диагностирована функционирующая опухоль, у 166 — нефункционирующая. 88 (38%) больных оставлены под динамическое наблюдение, 74 (32%) больным проведено хирургическое лечение, 68 (28%) больных получают противоопухолевую терапию АСС, 4 пациента (2%) получили пептид-рецепторную радионуклидную терапию 177-Lu. Среди НЭО тонкой кишки у 28 (47%) больных первично диагностированы метастазы в печени, у 14 (24%) локорегионарные метастазы, в 17 (29%) случаях диагностирована локальная опухоль. 33 (56%) пациентам выполнено хирургическое лечение, 27 (46%) пациентов получают системную лекарственную противоопухолевую терапию аналогами соматостатина пролонгированного действия (АСС), в том числе в 5 случаях эверолимус по поводу прогрессирования заболевания.
Заключение. Общая заболеваемость НЭО растет. В общей структуре преобладают НЭО ЖКТ. Современные инструментальные методы диагностики в большинстве случаев позволяют определить локализацию НЭО и оценить распространенность опухолевого процесса. Хирургический метод является основным в лечении НЭО, комплексное лечение обладает достоверным преимуществом в лечении больных генерализованными формами опухолей.
Актуальность. Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу новообразований, происходящих из нейроэндокринных клеток эмбриональной кишки. НЭО встречаются во всех органах, имеющих нейроэндокринные клетки. По данным регистра Московского клинического научного центра им. А.С. Логинова, который введется с 2017 года и насчитывает 723 пациента, самая частая локализация НЭО — поджелудочная железа. В международной литературе крайне мало публикаций по этой теме, а при анализе отечественных работ не было найдено материалов по данной тематике.
Материалы и методы. Стандартных подходов к выбору тактики ведения и лечения НЭО ПЖ на фоне беременности нет, в связи с этим представляем редкий клинический случай пациентки с НЭО ПЖ и беременностью, верифицированной после зачатия, с благоприятным исходом как для матери, так и для ребенка.
Результаты. Представляем клинический случай НЭО ПЖ, выявленной во время беременности. Пациентка Г., 35 лет, на сроке 14 недели беременности обратилась в поликлинику по м/ж с жалобами на боли в эпигастрии. Настоящая беременность у пациентки — вторая. Гинекологический анамнез: менструальный цикл с 12 лет, регулярный, через 28–30 дней, по 5 дней. Гинекологические заболевания: миома матки, состояние после миомэктомии. Наследственность по онкологическим заболеваниям не отягощена. При обследовании выполнено УЗИ ОПБ, по данным которого выявлено образование хвоста ПЖ размером до 2 см (может соответствовать НЭО). В июле 2022 г. выполнено ЭндоУЗИ, по данным которого: эндосонографическая картина новообразования хвоста ПЖ, характерна для НЭО, технически возможно выполнение пункции под контролем эндосонографии. В июле 2022 г. выполнено МРТ ОБП без контраста: образование на границе тела/хвоста ПЖ с ровными конутрами без признаков инфильтрации. В августе 2022 г. выполнена биопсия образования ПЖ. Заключение: цитологическая картина соответствует НЭО G1, Ki67 — 1%. По данным лабаротных исследований: серотонин — 265 нг/мл (на фоне приема парацетамола), гастрин 21 мкЕд/мл , хромогранин А, РЭА, СА 19,9 — в пределах референсных значений. Учитывая данные клинико-лабораторного обследования установолен клинический диагноз: «Нейроэндокринная опухоль хвоста поджеулодчной сТ2N0M0 (G1)». Клинически нефункционирующая. После обследования повторно проведен мультидисциплинарный консилиум с участием онколога, акушера-гинеколога и принято решение: учитывая клинически нефункционирующую НЭО ПЖ, возможно пролонгировать беременность. Беременность протекала без особенностей. По медицинским показаниям на сроке 38 недель проведено кесарево сечение, родился здоровый мальчик весом 3750 г, ростом 51 см. Оценка по шкале Апгар — 8/9 баллов. Кровотечение в родах 200 мл. Течение послеродового периода гладкое. В марте 2023 г. выполнено контрольное МРТ ОБП с в/в контрастированием: в области границы тела и хвоста ПЖ сохраняется округлое образование размерами до 22 мм. Без динамики. В настоящее время пациентка наблюдается согласно стандартам обследования и наблюдения.
Заключение. Нейроэндокринные опухоли во время беременности возникают довольно редко. Ведение пациенток с НЭО на фоне беременности должно быть мультидисциплинарным. Совместное лечение и ведение пациенток акушером-гинекологом и онкологом позволяет своевременно определить тактику ведения, сроки и способ родоразрешения, а также снизить риск предполагаемых осложнений у матери и плода.
Актуальность. Пептид-рецепторная радионуклидная терапия (ПРРТ) является компонентом современного подхода к лечению метастатических высокодифференцированных нейроэндокринных опухолей желудочно-кишечного тракта. Данный вид лечения позволяет достигнуть лучшей безрецидивной и общей выживаемости в большинстве случаев.
Материалы и методы. Представить собственный опыт применения пептид-рецепторной радионуклидной терапии в лечении пациента с метастатической высокодифференцированной нейроэндокринной опухолью поджелудочной железы. Пациент 50 лет, с диагнозом «Нейроэндокринная опухоль тела поджелудочной железы» G2 T4N1M1a (hep).
Результаты. В октябре 2018 г. обратился по месту жительства с жалобами на боли в эпигастрии, выполнено УЗИ ОБП, по данным которого: в теле поджелудочной железы визуализируется опухолевое образование. В мае 2019 г. обратился в МКНЦ им. А.С. Логинова. Проведено дообследование. Маркеры НЭО в пределах нормы. В июне 2019-го выполнена биопсия образования в печени. Гистологическое и иммуногистохимическое заключение: высокодифференцированная нейроэндокринная опухоль. Митотическая активность 1/10. Выраженная диффузная экспрессия синаптофизина, в единичных — слабая экспрессия хромогранина, выраженная экспрессия рецепторов соматостатина 2 типа. По данным КТ, в теле поджелудочной железы визуализируется гиперваскулярное образование размерами до 3,5 см, с инвазией в селезеночную артерию и вену. Парапанкреатическая клетчатка инфильтрирована с распространением вдоль чревного ствола. Также отмечается метастатический очаг в печени. С 25 июня 2019 г. пациент получал ланреотид 120 мг и эверолимус 10 мг. В феврале 2019 г. отмечается стабилизация. По данным ПЭТ-КТ, образование в теле поджелудочной железы без динамики, очаг в печени уменьшился на 20%. В июле 2020 г. отмечается прогрессирование заболевания. По данным ПЭТ-КТ, образование в теле поджелудочной железы без динамики, однако отмечается появление новых очагов в печени и увеличение ранее описанного очага на 30%. С мая по июль 2021 г. проведено 2 сеанса ПРРТ с 177 Lu. При контрольном обследовании, по данным ПЭТ-КТ, образование в поджелудочной железе до 2,5 см (ранее было до 3,5 см) и отмечается регресс очагов в печени. В октябре 2021 г. выполнена лапароскопическая дистальная корпорокаудальная резекция поджелудочной железы. Выписан из стационара на 9-е сутки в удовлетворительном состоянии. Клинический ответ на лечение пептид-рецепторной радионуклидной терапией появился спустя 2 сеанса, в виде полного регресса очагов в печени. При контрольном обследовании, по данным ПЭТ-КТ, патологического накопления радиофармпрепарата не отмечено, раннее описанные очаги в печени не визуализируются. В настоящее время пациент получает поддерживающую терапию ланреотидом 120 мг.
Заключение. Лечение больных с НЭО в каждом случае требует мультидисциплинарного обсуждения в рамках расширенного онкологического консилиума. Аналоги соматостатина пролонгированного эффекта являются препаратами выбора первой линии лечения больных с НЭО. Применение таргетных препаратов является стандартным подходом в лечении диссеминированных больных, позволяющим достичь стабилизации до 14 месяцев. Пептид-рецепторная радионуклидная терапия является эффективным методом лечения метастатических НЭО поджелудочной железы, которая должна проходить в рамках специализированных высокопотоковых отделений.
Актуальность. Нейроэндокринные опухоли (HЭО) — гетерогенная группа новообразований, происходящих из нейроэндокринных клеток эмбриональной кишки, обладающих биологически активными свойствами. Интенсивные показатели частоты возникновения нейроэндокринных опухолей легкого имеют тенденцию к увеличению за последние десятилетия. Это связано с расширением спектра диагностических методов, а также с повышением доступности высококачественных методов диагностики.
Материалы и методы. С 2015 г. в Московском клиническом научном центре им. А.С. Логинова ведется регистр пациентов с нейроэндокринными опухолями различной локализации. В данной работе представлены результаты наблюдения и лечения больных с нейроэндокринными опухолями бронхопульмональной системы и тимуса. Под наблюдением в регистре находились все больные, которые обратились за помощью в МКНЦ им. А.С. Логинова.
Результаты. В Московском научном клиническом центре имени А.С. Логинова под наблюдением находятся 719 пациентов с НЭО различной локализации, среди которых 625 пациентов (87%) с НЭО желудочно-кишечного тракта (НЭО ЖКТ). Самой частой локализацией вне желудочно-кишечного тракта являются нейроэндокринные опухоли бронхопульмональной системы и тимуса: 26 пациентов (28%). Среди них было 7 (27%) женщин и 19 (73%) мужчин, в возрасте от 21 до 75 лет. Средний период наблюдения составляет 26 месяцев (от 11 до 77). У 17 пациентов (65%) опухоль располагалась центрально, у 9 больных (35%) имела место периферическая форма роста опухоли. У 7 больных (27%) опухоль протекала бессимптомно и была выявлена случайно при профилактическом обследовании, 19 больных (73%) обратились за медицинской помощью в МКНЦ им А.С. Логинова и были обследованы в связи появлением симптомов заболевания. Кашель беспокоил 11 больных (42%), лихорадка была у 4 (15%), одышка у 5 (19%), боли в грудной клетке у 7 (27%). АКТГ-эктопия диагностирована у 4 пациентов (15%). Всем пациентам было проведено хирургическое лечение. Лобэктомия выполнена в 16 случаях, 5 пациентам проведена билобэктомия, пневмонэктомия проведена 5 пациентам. У 15 пациентов при плановом гистологическом исследовании выявлен типичный карциноид, у 7 пациентов выявлен атипичный карциноид, в 4 случаях выявлен мелкоклеточный рак легкого. Лимфогенные и гематогенные метастазы при типичных карционоидах встречаются в 4 случаях, при атипичных — в 3 случаях, при мелкоклеточном раке легкого — в 4 случаях. Больным с метастатическим поражением лимфатических узлов в послеоперационном периоде проведена химиотерапия.
Заключение. Заболеваемость НЭО неуклонно растет. В общей структуре преобладают нейроэндокринные опухоли желудочно-кишечного тракта. Среди локализаций вне желудочно-кишечного тракта преобладают нейроэндокринные опухоли бронхопульмональной системы и тимуса. Карционоидные опухоли характеризуются относительно благоприятным прогнозом. Ранняя диагностика позволяет проводить радикальное хирургическое лечение. Золотым методом выбора в лечении на данный момент является хирургический, однако требуется более длительный период наблюдения и большая величина когорты для формирования окончательной позиции.
Актуальность. Распространенность нейроэндокринных опухолей неуклонно растет в течение последних десятилетий. Это связано в первую очередь с повышением доступности высококачественных методов диагностики.
Материалы и методы. Результаты наблюдения и лечения больных НЭО ЖКТ из регистра МКНЦ им. А.С. Логинова. Под наблюдением находились все больные, обращавшиеся за помощью в МКНЦ им. А.С. Логинова. При выявлении локальных форм проводилось радикальное хирургическое лечение, в случае невозможности оперативного лечения — системная противоопухолевая терапия.
Результаты. В настоящее время в МКНЦ им. А.С. Логинова наблюдаются 602 пациента с НЭО различной локализации, среди которых 525 — с НЭО ЖКТ (87% от общего числа заболеваемости НЭО). Среди них 171 пациент (28%) — мужчины и 431 (78%) женщины, средний возраст больных НЭО ЖКТ 59,1±14,5 года. Средний период наблюдения составляет 38 месяцев (от 4 до 74). Наиболее часто НЭО ЖКТ локализовались в желудке — 173 (33%), поджелудочной железе — 230 (44%), тонкой кишке — 59 (11%). Значительно реже НЭО выявлялись в других отделах ЖКТ: двенадцатиперстной кишке — 26 (5%) больных, червеобразном отростке — 7 (1%) больных, толстой и прямой кишке — 26 (5%) больных. Среди НЭО желудка преобладает 1 тип по ВОЗ — 142 пациента, 2 тип — 12 пациентов, 3 тип — 19 пациентов. 87 (50%) пациентам выполнено хирургическое лечение, 75 (43%) оставлены под динамическое наблюдение, 11 (7%) получают противоопухолевую терапию. Среди НЭО тонкой кишки у 28 (47%) больных первично диагностированы метастазы в печени, у 14 (24%) локорегионарные метастазы, в 17 (29%) случаях диагностирована локальная опухоль. 33 (56%) пациентам выполнено хирургическое лечение, 27 (46%) пациентов получают системную лекарственную противоопухолевую терапию аналогами соматостатина пролонгированного действия (АСС), в том числе в 5 случаях эверолимус по поводу прогрессирования заболевания. Среди НЭО поджелудочной железы (НЭО ПЖ) у 92 пациентов диагностирована функционирующая опухоль, у 138 — нефункционирующая. 88 (38 %) больных оставлены под динамическое наблюдение, 74 (32%) больным проведено хирургическое лечение, 68 (28%) больных получают противоопухолевую терапию АСС, 4 пациента (2%) получили пептид-рецепторную радионуклидную терапию 177-Lu.
Заключение. Общая заболеваемость нейроэндокринными опухолями растет. В общей структуре преобладают НЭО ЖКТ. Чаще всего встречаются НЭО желудка, поджелудочной железы, тонкой кишки. Среди НЭО желудка прогностически благоприятный 1 тип по ВОЗ. НЭО ПЖ часто выявляются на 1 стадии с индолетным доброкачественным течением. Среди опухолей тонкой кишки преобладают пациенты на распространенной стадии.
Актуальность. Нейроэндокринные опухоли тонкой кишки являются редкими и медленно растущими, которые возникают из нейроэндокринных клеток желудочно-кишечного тракта, синтезирующих вазоактивные молекулы. Внедрение в повседневную клиническую практику современных методов инструментальной и морфологической диагностики привело к увеличению частоты заболеваемости за последние десятилетия.
Материалы и методы. Проведен анализ результатов обследования и лечения 65 пациентов НЭО ТК. Мужчин было 33, женщин 32. Возраст пациентов — от 23 до 91 года, составив в среднем 59,1±14,5 года. Средний период наблюдения — 38 месяцев (от 4 до 74). У 32 больных первично диагностированы метастазы в печени, у 14 пациентов имелись локорегионарные метастазы, в 19 случаях диагностирована локальная опухоль. По результатам морфологической верификации у 34 больных диагностирована НЭО G1, у 28 пациентов — НЭО G2 и в 3 случаях — НЭО G3.
Результаты. По результатам проведенного анализа было установлено, что причиной обращения за медицинской помощью у 24 (36,9%) больных стали боли в животе. Проявление карциноидного синдрома диагностировано у 9 пациентов (13,8%), среди которых метастатическое поражение печени установлено. Развитие осложнений опухолевого процесса привело к выявлению НЭО ТК у 10 (15,4%) пациентов в виде острой кишечной непроходимости. У 21 (32,3%) пациента диагностировано случайно при профилактическом осмотре. Изучение результатов исследования маркеров НЭО позволило установить менее чем 3-кратное повышение уровня ХГА, серотонина и 5-ГИУК. Осмотр терминального отдела тонкой кишки при проведении ФКС обеспечил визуализацию НЭО у 13 пациентов. Применение ПЭТ-КТ с 68Ga-DOTA-TATE/TATE позволило локализовать НЭО в тонкой кишке у 23 пациентов, а также определить метастатические очаги и уточнить распространенность процесса. В зависимости от объема замещения печеночной паренхимы метастазами поражение печени I типа (единичные метастазы в одной доле) установлено у 7 пациентов, II типа (множественные метастазы в одной доле и единичные в другой) — у 6 пациентов, III типа (множественные метастазы в обеих долях) — у 12 пациентов. Хирургическое лечение проведено 34 пациентам (52,3%) из 65, в том числе в 10 случаях по поводу тонкокишечной непроходимости. Послеоперационные осложнения, которые повлекли за собой повторное хирургическое вмешательство, было у 1 пациента. Эндоскопическое удаление опухоли выполнено у 2 пациентов, резекция тонкой кишки — у 28 пациентов, правосторонняя гемиколэктомия — у 4 пациентов. Средний размер удаленных новообразований составил 31 мм (от 7 до 130 мм). В настоящее время 27 пациентов (41,5%) получают противоопухолевую терапию АСС, в том числе в 6 случаях эверолимус по поводу прогрессирования на первой линии лечения.
Заключение. Нейроэндокринные опухоли тонкой кишки чаще всего диагностируют как метастатические или местно-распространенные. Основной причиной поздней диагностики является длительное бессимптомное течение заболевания, а также наличие неспецифических клинических проявлений. Наибольшую информативность в диагностике НЭО ТК демонстрирует МСКТ и ПЭТ-КТ. Хирургический метод является основным в лечении больных НЭО ТК, в свою очередь ранняя диагностика позволяет проводить радикальное хирургическое лечение.
Актуальность. Нейроэндокринные опухоли (НЭО) прямой кишки — редкие новообразования, развивающиеся из нейроэндокринных клеток эмбриональной ткани — апудоцитов, продуцирующие глюкагон-подобный пептид. По данным международной литературы, НЭО прямой кишки составляют 0,4% от всех колоректальных опухолей. Ежегодно выявляемость НЭО прямой кишки составляет 0,76 случаев на 100 000 населения.
Материалы и методы. Проведен анализ пациентов с НЭО прямой кишки за период с 2015 по 2023 год, находившихся на лечении в МКНЦ им. А.С. Логинова. Всего проанализировано 25 пациентов с верифицированной НЭО прямой кишки. При подозрении на опухолевую патологию выполнялся стандартный алгоритм диагностических мероприятий, включающий в себя ФКС с биопсией очага поражения. Для определения метастатического поражения использовалось КТ и/или МРТ в сочетании с ПЭТ-КТ. Лабороторная диагностика заключалась в определении маркеров НЭО (хромогранин А, серотонин, нейронспецифическая энолаза).
Результаты. Проведен анализ 25 пациентов с верифицированной НЭО прямой кишки. Медиана возраста составила 65 лет. Средний возраст при постановке диагноза составляет 52,4 года. Мужчин было 9 (36%), женщин 16 (64%). Среднее время наблюдения за пациентами составило 42 месяца (от 11 до 100 месяцев). Средний размер опухоли составил 1,3 см (от 0,6 до 5,1 см). У 13 пациентов опухоль диагностирована случайно при профилактическом осмотре, у 12 пациентов проявлением заболевания являлось: прямокишечное кровотечение, боль, запоры, потеря веса, а также раздражение кожи анальной области. По данным международной литературы, частота метастазирования при размере опухоли менее 1 см составляет 3%, до 2 см — в 10–15%, более 2 см — 60–80%. По данным регистра МКНЦ им. А.С. Логинова, из 25 пациентов метастазирование наблюдалось у 8: в печень у 6 пациентов, в лимфатические узлы у 2 пациентов. У 1 (12,5%) пациента размер опухоли менее 1 см, у 2 (25%) пациентов размер опухоли до 2 см, у 5 (62,5%) пациентов размер опухоли более 2 см. Локализованные формы диагностированы у 12 пациентов, местнораспространенные у 6 пациентов, метастатические у 7 пациентов. По данным предоперационного обследования, у 12 пациентов наблюдалась инвазия в пределах подслизистого слоя прямой кишки и отсутствовали признаки поражения регионарных лимфатических узлов. Им было выполнено эндоскопическое трансанальное удаление опухоли. Гемиколэктомия выполнена в 3 случаях. Послеоперационных осложнений не было. Средний послеоперационный койко-день составил 7 дней. По результатам патоморфологического исследования: у 7 пациентов рТ1а стадия, у 6 пациентов pT1b, у 3 пациентов рТ2, у 6 пациентов рТ3, у 2 пациентов рТ4. 10 пациентов получают противоопухолевую терапию, 3 пациента прогрессировали после хирургического лечения в указанный период и начали получать системную противоопухолевую терапию.
Заключение. Нейроэндокринные опухоли прямой кишки — редкая патология, которая требует мультидисплинарного подхода. Чаще всего НЭО прямой кишки протекает асимптомно. Большинство НЭО прямой кишки представляют собой локализованные опухоли небольших размеров. При размере опухоли менее 1 см прогноз благоприятный. Выбор метода лечения зависит от локализации, размера образования, степени и глубины инвазии, наличия или отсутствия метастазов. На сегодняшний день золотым стандаром лечения НЭО прямой кишки является хирургический, однако требуется более длительный период наблюдения и большая величина когорты для формирования окончательной позиции.
Актуальность. Хемодектома (нехромаффинная параганглиома) — редкая нейроэктодермальная опухоль из рецепторных клеток-афферентных параганглиев. Частота этих опухолей среди всех онкологических заболеваний головы и шеи, по данным международной литературы, не превышает 0,01%, а из общего числа внеорганных опухолей шеи на долю параганглиом приходится 0,5–0,9%. Практический интерес к хемодектомам за последнее десятилетие возрос, что обусловлено в первую очередь скудностью клинических проявлений, трудностями дифференциальной клинической и морфологической диагностики, сложностью и опасностью хирургического лечения, которое в современных условиях должно выполняться в специализированных лечебных учреждениях, имеющих опыт и условия для ангиохирургических вмешательств.
Материалы и методы. Исследованы 12 больных с хемодектомами шеи, проходившие обследование и лечение в Московском клиническом научном центре им. А.С. Логинова в период с 2017 по 2022 гг. Среди них было 11 женщин и 1 мужчина. Средний возраст пациентов варьировал от 20 до 74 лет, составив в среднем 52 года. Средний период наблюдения составляет 23 месяца (от 20 до 66). У 11 пациентов была односторонняя локализация опухоли (у 6 — слева, у 5 — справа), у 1 пациентки была двухсторонняя локализация опухоли. Метастазирование процесса было выявлено в 1 случае.
Результаты. Самая частая жалоба, которую предъявляли пациенты, — опухолевидное образование на шее, причиняющее дискомфорт и формирующее косметический дефект (90%), головная боль (70%), дискомфорт в горле при глотании (20%), шум в ушах (10%). Физикальное обследование больных выявляло наличие объемного образования на шее средними размерами 35х40±24 мм. Всем пациентам на дооперационном этапе выполнялось ультразвуковое триплексное сканирование и мультиспиральная компьютерная томоангиография БЦА. Согласно классификации Shamblin W.R. et al. (1971), пациенты с хемодектомами были разделены на группы: 1 тип — 6 пациентов, 2 тип — 4 пациента, 3 тип — 2 пациента. В 1 случае каротидная хемодектома имела двустороннюю локализацию. Всего было радикально прооперировано 11 пациентов. Радикальность удаления у пациентов была подтверждена данными МСКТ. В одном случае было выполнено двухэтапное оперативное лечение, интервал между операциями составил 1 месяц. У 10 больных опухоли были удалены без нарушения целостности сосудов шеи. В одном случае пациенту с 3 типом опухоли выполнено протезирование внутренней сонной артерии. Время оперативного вмешательства варьировалось от 60 до 190 минут. Интраоперационная кровопотеря составила от 100 до 500 мл (в среднем 200 мл). При гистологическом исследовании диагноз хемодектомы шеи был верифицирован во всех случаях. Послеоперационный период протекал удовлетворительно. Послеоперационные осложнения отмечены у 2 больных — у 1 пациента, оперированного в другом регионе, получил осложнение в виде ишемического инсульта в ипсилатеральном полушарии, в 1 случае паракатетериальным тромбозом левой бедренной вены. Летальных исходов не было. Все больные выписаны в удовлетворительном состоянии. У 1 пациента отмечено ранее генерализованное диссеминирование опухоли, в связи с этим в настощее время он получил 4 сеанса пептид-рецепторной радионуклидной терапии (3 сеанса с 177-Lu, 1 сеанс с Ас.).
Заключение. Хемодектома шеи — редкие заболевания области головы и шеи, составляющие около 0,6% всех опухолей этой зоны. Хемодектомы чаще встречаются у женщин среднего возраста. Тщательное обследование с обязательным выполнением методов послойного сканирования с болюсным контрастированием позволяет точно оценить распространенность опухоли и спланировать объем хирургического вмешательства. Риск развития осложнений для опухолей 3 типа существенно выше, чем для двух предыдущих типов. Радикальное удаление хемодектом 3 типа возможно лишь в сочетании с резекцией сонных артерий с последующим восстановлением магистрального кровотока. Лечение хемодектом шеи должно проходить в рамках специализированных высокопотоковых отделений.
Актуальность. Пептид-рецепторная радионуклидная терапия (ПРРТ) является компонентом современного подхода к лечению метастатических высокодифференцированных нейроэндокринных опухолей желудочно-кишечного тракта. Данный вид лечения позволяет достигнуть лучшей безрецидивной и общей выживаемости в большинстве случаев, что подтверждено в ряде международных исследований.
Материалы и методы. Представить результаты лечения больных метастатическими нейроэндокринными опухолями поджелудочной железы с применением ПРРТ. Представлены результаты лечения 3 больных, в возрасте 50, 51 и 53 лет, среди которых 2 женщины и 1 мужчина, с верифицированными метастазами высокодифференцированной НЭО ПЖ в печени.
Результаты. У двух больных (Больной 1 и Больной 2) были диагностированы первично распространенные НЭО G2 поджелудочной железы, в теле и хвосте соответственно, с метастазами в печени. У больной 3 (Б3) было выполнено радикальное лечение по поводу НЭО G1 хвоста поджелудочной железы, с последующей панкреатоэктомией через 16 месяцев по поводу рецидива НЭО G2 в головке поджелудочной железы, с дальнейшим прогрессированием в области чревного ствола и метастазами НЭО G1 в печени. Все больные получали системную лекарственную противоопухолевую терапию в соответствии с одобренными протоколами. Больной 1 (Б1) — эверолимус 10 мг + ланреотид 120 мг в течение 13 месяцев до прогрессирования. Больной 2 (Б2) после удаления первичного очага НЭО G2 в хвосте ПЖ в течение 23 месяцев получала сунитиниб 37,5 мг и ланреотид (последние 6 месяцев) до прогрессирования. Больная 3 (Б3) после прогрессирования получала различные одобренные схемы лекарственного лечения в течение 99 месяцев с эпизодами стабилизации и прогрессирования. Всем больным в период с 09.2020 по 09.2022 года проводилась системная радионуклидная терапия Lu177. У Б1 после 2 сеансов отмечался полный ответ со стороны метастазов в печени и частичный ответ со стороны первичного очага, что позволило провести радикальное хирургическое лечение. У Б2 после 6 сеансов Lu177 и РЧА очага в печени удалось добиться полного ответа в течение 6 месяцев. У Б3 после 3 сеансов Lu177 зарегистрирован значимый ответ со стороны локорегионального рецидива и полный регресс метастазов в печени.
Заключение. Системная радионуклидная терапия Lu177 является эффективным методом лечения больных диссеминированными высокодифференцированными НЭО ПЖ, однако требуется большая выборка и более длительный период наблюдения для оценки долгосрочной эффективности метода.
Актуальность. Адоптивная иммунотерапия (АИТ) с использованием NK-клеток представляет собой перспективное направление лечения пациентов с онкологическими заболеваниями. Эффективность АИТ при лечении рака молочной железы (РМЖ) продемонстрирована в клинических исследованиях. Особенно актуальным является представление о возможностях иммунотерапии при наиболее агрессивных формах, таких как трижды негативный РМЖ.
Материалы и методы. Пациентка Ш., 62 г., в октябре 2021 г. установлен диагноз: инфильтративный протоковый рак левой молочной железы (ЛМЖ) T3NxM0, Grade 2, тройной негативный подтип, CHEK-2 ассоциированный. По данным ПЭТ-КТ, размер опухоли 43х21 мм. От полихимиотерапии пациентка отказалась. Перед АИТ для получения цитокин-индуцированных киллеров (ЦИК) проводился забор крови, из которой выделялись мононуклеарные клетки и культивировались в присутствии цитокинов на протяжении 10–14 дней. АИТ проводилась внутрикожно паравертебрально 1 раз в неделю, без перерыва до настоящего времени. На фоне АИТ проводились ПЭТ-КТ, МРТ, УЗИ и иммунофенотипирование крови.
Результаты. В ноябре 2021 г. была начата АИТ. За год проведено 3 курса АИТ, суммарно введено 225 млн ЦИК. На фоне АИТ отмечалась местная гиперемия и гриппоподобный синдром, иных побочных эффектов не выявлялось. Через 6 месяцев после начала АИТ, по данным ПЭТ-КТ, отмечалась положительная динамика: снижение активности образования ЛМЖ SUVmax 16,76 (ранее SUVmax 28,74) с сохранением прежних размеров, ранее выявленных признаков остеобластических изменений в позвоночнике на уровне Th12 не обнаружено. По результатам ПЭТ-КТ в ноябре 2022 года отмечалось некоторое увеличение размеров образования ЛМЖ до 49х35 мм (SUVmax 16,82), при этом был обнаружен очаг фиксации радиофармпрепарата в теле L2 позвонка и сигмовидной кишке. В начале декабря 2022 г., проведено хирургическое лечение в объеме радикальной мастэктомии. Установлен терапевтический патоморфоз 2 степени, размер опухоли 5,3 см, край резекции без клеток опухоли, в 2 лимфатических узлах из 14 обнаружены метастазы. Через 2 недели была возобновлена АИТ. С целью профилактики рецидива проведен 4 курс АИТ с внутривенным введением NK-клеток в количестве 460 млн. За период с января 2023 по октябрь 2023 г. суммарно было введено 303 млн ЦИК. Терапию пациентка переносила удовлетворительно, побочных эффектов не наблюдалось. По данным МРТ, в марте 2023 г. данных за рецидив не получено. До АИТ количество T-клеток составляло 79,3%, а NK-клеток — 4,2%. В процессе терапии иммунологические показатели были стабильны.
Заключение. Средняя продолжительность жизни больных с трижды негативным РМЖ с наличием метастазов составляет менее 1 года. В описанном клиническом случае с момента постановки диагноза прошло 24 месяца, что свидетельствует об эффективном сочетании АИТ с хирургическим методом лечения. Все это позволяет сделать вывод о высоком потенциале эффективности АИТ ЦИК.
Актуальность. Рак околощитовидных желез (ОЩЖ) — редкая нейроэндокринная патология с развитием тяжелого гиперпаратиреоза, множественными метаболическими нарушениями и неблагоприятным клиническим прогнозом.
Описание клинического случая. Пациент 46 лет, с 6-месячным анамнезом компрессионных переломов Th7, Th8, снижением веса на 13 кг, роста на 5 см, на терапии деносумабом, витамином D3 по диагнозу «Остеопороз». При дообследовании у эндокринолога выявлен сахарный диабет (назначена инсулинотерапия), артериальная гипертензия, гиперкальциемия (кальций — 3,4 ммоль/л), повышение ПТГ> 5000 пг/мл, на УЗИ — увеличение левой нижней ОЩЖ. Через 3 мес амбулаторного обследования пациент госпитализирован в связи с нарастающей кальциемией (расчетный кальций — 3,75 ммоль/л). В стационаре ПТГ — 3470 пг/мл, фосфор — 1,5 ммоль/л, гемоглобин — 73 г/л, СКФ 24 мл/мин (конкрементов в почках не выявлено). На МСКТ в средостении — образование 45×52 мм, в S2 правого легкого — очаг 9×11 мм, в костях — множественные участки остеодеструкции. В клинике проводилась инфузионная терапия, инсулинотерапия, цинакальцет, экстренно выполнена селективная паратиреоидэктомия слева (иммуногистохимическое заключение: карцинома ОЩЖ). После операции уровень ПТГ и кальция оставались высокими, очаг в легком расценен как метастатическое поражение, проведена лобэктомия справа с билатеральной медиастинальной лимфаденэктомией (очаг — карцинома ОЩЖ). В послеоперационном периоде отмечено снижение ПТГ до 200 пг/мл, развитие тяжелой гипокальциемии (синдром «голодных костей»), в течение 8 месяцев проводилась терапия препаратами кальция и альфакальцидола. При нормализации кальциемии терапия была отменена, продолжена терапия деносумабом 60 мг п/к 1 раз в 6 мес. После операции отмечалась также нормализация гликемии, сахароснижающая терапия отменена. Длительно сохраняющееся повышение ПТГ после оперативного лечения было расценено как вторичный гиперпаратиреоз на фоне ХБП С4, гипокальциемии при развитии синдрома «голодных костей». Однако через 1,5 года после операции отмечено значительное нарастание ПТГ и кальциемии, данными инструментального обследования подтверждено метастатическое поражение печени, костей. К терапии был добавлен сорафениб, продолжена терапия деносумабом. Одновременно отмечено нарастание креатинина, ухудшение углеводного обмена, назначена инсулинотерапия в базис-болюсном режиме.
Обсуждение. Особенностью клинического случая является развитие сахарного диабета на фоне гиперпаратиреоза с нормализацией показателей углеводного обмена в послеоперационном периоде и нарастанием гликемии при рецидиве заболевания.
Заключение. Развитие тяжелого гиперпаратиреоза с множественными осложнениями и метаболическими расстройствами (развитие ХБП, тяжелого остеопороза, анемического синдрома, сахарного диабета, артериальной гипертензии) значительно ухудшает течение заболевания, качество жизни и прогноз. Дооперационная диагностика рака ОЩЖ остается нерешенной клинической проблемой, разработка специфических маркеров заболевания является актуальной областью научных исследований.
Актуальность. Медуллярный рак щитовидной железы (МРЩЖ) имеет аутосомно-доминантный тип наследования и является одной из наиболее агрессивных форм злокачественных новообразований щитовидной железы. В соответствии с клиническими рекомендациями, всем пациентам, имеющим диагноз МРЩЖ или семейный анамнез МРЩЖ или синдрома МЭН 2-го типа, рекомендовано генетическое исследование для определения герминальной мутации гена RET для определения прогноза заболевания. Ген RET расположен на 10-й хромосоме, кодирует трансмембранный рецептор тирозинкиназы. Активация данного рецептора приводит к бесконтрольной пролиферации С-клеток. Наличие герминальной мутации RET помогает клиницисту дифференцировать спорадические случаи и наследственные формы МРЩЖ, а отдельные варианты мутаций могут указывать на предрасположенность к определенному фенотипу и клиническому течению (например, случаи раннего выявления феохромоцитомы и первичного гиперпаратиреоза). Определение точечных соматических мутаций в гене RET позволяет выбрать тактику лечения МРЩЖ и назначить таргетную терапию. Целью предстоящей работы является разработка, валидация и внедрение тест-системы для выявления наиболее часто встречающихся патогенных мутаций в протоонкогене RET, ассоциированных с развитием МРЩЖ. Разрабатываемая тест-система основана на проведении ПЦР в реальном времени с использованием аллель-специфичных Taqman зондов, комплементарных определенным нуклеотидным последовательностям, несущим последовательность-мишень (мутацию).
Материалы и методы. ДНК из парафиновых блоков (FFPE) и цельной крови пациентов получали с использованием набора GeneRead DNA FFPE Kit (Qiagen) и HiPure Universal DNA Kit (Magen) соответственно. Количественная и качественная оценка ДНК проводилась с использованием спектрофотометра BioSpectrometer Eppendorf. Соотношение A260/280 для всех образцов составляло не менее 1,8, A260/230 — не менее 2,0. Дизайн праймеров и зондов для детекции SNP выполнен с использованием программных инструментов Benchling.com, OligoCalc и Primer-BLAST. Молекулярно-диагностический анализ SNP проводился на приборе QuantStudio5 (Thermo Fisher Scientific). РЕЗУЛЬТАТЫ. Произведен дизайн праймеров и зондов для детекции 6 генетических вариантов в 11, 13, 14 и 16 экзонах (rs78014899, rs75030001, rs79658334, rs78347871, rs75076352, rs377767406), приводящих к аминокислотным заменам цистеин-богатого и тирозинкиназного доменов рецептора RET выполнен. Подобраны и оптимизированы температурные и физико-химические условия для проведения ПЦР в реальном времени. Показана экономически целесообразная возможность тестирования на наличие мутаций в гене RET c помощью ПЦР в реальном времени с использованием Taqman зондов для детекции нескольких SNPs в пределах одного экзона. Проведен скриннинг 28 гетерозиготных образцов крови и парафиновых блоков пациентов (в паре), с использованием метода секвенирования соответствующих экзонов гена RET по Сенгеру в качестве контроля.
Заключение. В перспективе планируется применение данной тест-системы в клинике с целью определения чувствительности к таргетной терапии селективными RET-ингибиторами для направления пациентов в клинические исследования и разработки клинических рекомендаций.
Актуальность. Согласно данным статистики, частота встречаемости нейроэндокринных опухолей ЖКТ составляет 0,2–0,4 случая на 100 тыс. населения. Однако, по данным ряда исследований, пятилетняя выживаемость при названных новообразованиях крайне низкая: составляет около 56% для высокодифференцированных и 5,2% для низкодифференцированных. Именно поэтому вопрос терапии нейроэндокринных опухолей является актуальным. Многочисленные исследования демонстрируют, что нейроэндокринные опухоли имеют высокую васкуляризацию, продуцируют большое количество факторов роста, которые являются мишенями для действия таргетных препаратов.
Цель. Рассмотреть перспективные подходы к терапии нейроэндокринных опухолей ЖКТ.
Материалы и методы. Анализ доступных литературных данных по теме исследования.
Результаты. Одним из перспективных подходов к терапии нейроэндокринных опухолей ЖКТ является экспрессия сосудистого эндотелиального фактора роста (VEGF), поскольку доказано, что повышенная экспрессия эндотелиального фактора роста ведет к усилению ангиогенеза и снижению выживаемости пациентов с высокодифференцированными нейроэндокринными опухолями. Способностью к связыванию VEGF обладает препарат бевацизумаб, который представляет собой рекомбинантные моноклональные IgG1 антитела. Однако стоит отметить, что данные антитела наиболее эффективно действуют на рост новых сосудов, по мере стабилизации сосудистой системы опухоли действие их снижается. Ингибиторы тирозинкиназы проявляют активность умеренной степени по отношению к VEGF и VEGFR. Так, в ряде исследований был установлен положительный эффект сунитиниба в терапии пациентов с высокодифференцированными нейроэндокринными опухолями. Данный препарат включен в рекомендации по лечению пациентов с подобными новообразованиями поджелудочной железы. Большую роль в онкогенезе играет ген mTOR, повышенная активность которого ведет к бесконтрольному делению клеток и прогрессированию опухоли. Именно поэтому применение препаратов, ингибирующих mTOR, например, эверолимуса, ведет к снижению клеточной пролиферации и повышению продолжительности жизни онкологических пациентов.
Заключение. На сегодняшний день проводится большое количество исследований, направленных на поиск новых лекарственных средств для лечения больных с нейроэндокринными опухолями. Перспективным является создание и внедрение комбинированных лекарственных препаратов.
Актуальность. На сегодняшний день большую популярность стала набирать тераностика. Тераностика представляет собой новое направление медицины, позволяющее применять препараты, с помощью которых одновременно можно проводить диагностику и терапию заболевания. Примером таких технологий является соматостатин-рецепторная радиотераностика у пациентов с нейроэндокринными опухолями.
Материалы и методы. Анализ доступных литературных источников, в которых освещены вопросы применения соматостатин-рецепторной тераностики у пациентов с нейроэндокринными опухолями.
Результаты. В большинстве случаев нейроэндокринные опухоли экспрессируют соматостатиновые рецепторы. В связи с этим аналоги соматостатина, способные связываться с данными рецепторами, выступают активными субстратами для однофотонной эмиссионной компьютерной томографии и позитронно-эмиссионной томографии. Так, введение радиоактивного лютеция-177 в состав радиофармпрепарата со сродством к соматостатиновым рецепторам позволило превратить диагностическое средство в терапевтическое. По результатам исследования J. Strosberg и соавт. применение 177Lu-DOTA-TATE в лечении пациентов с нейроэндокринными опухолями, содержащими соматостатин рецептор 2 типа, привело к улучшению выживаемости при хорошей переносимости лечения.
Заключение. Таким образом, тераностика помогает на ранней стадии определить, какие рецепторы экспрессирует опухоль и какие таргетные препараты необходимо применить в каждом конкретном случае, в чем и заключается персонализированный подход.
Актуальность. В России практически отсутствуют статистические данные по заболеваемости нейроэндокринными опухолями (НЭО). Согласно данным реестра SEER, в США заболеваемость НЭО на 2004 г. составила 5,25 случая на 100 тыс. чел., отмечается значительное увеличение заболеваемости НЭО [1]. В настоящий момент существуют подробные алгоритмы лечения данной патологии в РФ [2].
Цель. Представить личный опыт лечения нейроэндокринной опухоли прямой кишки.
Материалы и методы. Пациентка, 53 г., с диагнозом: НЭО прямой кишки сT1N0M1 4 ст. с множественными метастазами (МТС) в печени (до 75%), в лимфоузлы (л/у) ворот печени, паракавальные, парааортальные л/у. ИГХА: нейроэндокринная опухоль G2, положительная экспрессия РСК, synaptophysin, chromogranin, CD56, отрицательная экспрессия СК7, CDX2. Ki-67 до 15%. Пациентка чрезвычайно эмоционально лабильна, консультируется в различных медучреждениях и самостоятельно назначает себе обследования. Как следует из нашего личного опыта, такое тревожное поведение крайне характерно для пациентов с НЭО, что, вероятно, обусловлено биологией опухоли.
Результаты. Учитывая гистологическое строение опухоли, назначена биотерапия: ланреотид 120 мг 1 раз в 28 дней с 20.02.2023, продолжает по настоящее время. Последнее введение 04.09.2023. Проведено 7 курсов. Лучший зарегистрированный ответ — стабилизация. Прогрессия от 21.06.2023 в печень, в связи с чем с 03.07.2023 к ланреотиду добавлен эверолимус (10 мг в сутки ежедневно). Карциноидного синдрома нет. Клинически значимых негативных явлений не было. Состояние пациентки после лечения удовлетворительное. Контрольное обследование запланировано на конец сентября 2023 г.
Заключение. Современная био- и таргетная терапия эффективна у пациентов с умеренно дифференцированными НЭО даже при большой опухолевой нагрузке, что наглядно демонстрирует данный клинический случай.
Актуальность. Синдром Хиппеля-Линдау — редкое заболевание с аутосомно-доминантным типом наследования, характеризующееся развитием различных опухолей: гемангиобластомы ЦНС, феохромоцитомы, опухоли поджелудочной железы, почек, гемангиомы сетчатки. Причина — мутации в гене VHL, кодирующем белок-опухолевый супрессор.
Цель. Описание клинических случаев.
Описание случаев. Пациентка К., 16 лет. С 7 лет — головные боли, гипергидроз. С 15 лет — подъем артериального давления (АД) до 140/110 мм рт.ст., тахикардия. При обследовании обнаружено повышение в суточной моче уровня норметанефрина (664 мкг/сут, N до 277) и метанефрина (555,0 мкг/сут, N до 150). По данным компьютерной томографии (КТ), визуализированы феохромоцитомы надпочечников: в левом — образование размерами 36х31х41 мм, в правом — два образования размерами 22х19х24 мм и 13х12х26 мм. После достижения целевых значений АД и пульса на терапии альфа- и бета-адреноблокаторами проведена двусторонняя адреналэктомия, назначена заместительная терапия глюко- и минералокортикоидами. По данным патоморфологического исследования, подтверждена двусторонняя феохромоцитома (по шкале PASS 2 балла). Пациентке проведено исследование панели генов «Феохромоцитома»: в гене VHL обнаружен патогенный вариант c.475A>G (p.Lys159Glu) в гетерозиготном положении, что подтвердило синдром Хиппеля-Линдау. При обследовании пациентки в 16 лет не обнаружено других компонентов заболевания и признаков рецидива феохромоцитом. Аналогичная мутация обнаружена у отца пациентки, страдающего артериальной гипертензией с осложнениями, запланировано его обследование. У пациентки есть старший брат (30 лет), страдающий артериальной гипертензией, которому рекомендовано генетическое тестирование, но к настоящему времени оно не проведено.
Пациентка Ш., 13 лет. С 11 лет — гипергидроз, с 12 лет — повышение АД до 184/137 мм рт. ст. По данным КТ, обнаружены образования надпочечников: в левом — размерами 46х34х48 мм, в правом — 23х17х15 мм. В суточной моче обнаружено повышение уровня норметанефрина до 8132 мкг/сут (N до 150) при нормальном уровне метанефрина (62 мкг/сутки, N до 277). Также обнаружены два образования поджелудочной железы: на уровне головки размерами 8х8 мм, на уровне хвоста — 12х12 мм. Данных за гормональную активность этих образований не получено (гиперинсулинизм исключен по результатам пробы с голоданием, а уровни гастрина, соматостанина и глюкагона не были повышены). Учитывая сочетание феохромоцитом с образованиями поджелудочной железы, у пациентки заподозрен синдром Хиппеля-Линдау, который подтвержден генетическим тестированием: в гене VHL обнаружен патогенный вариант c.509T>G (p.Val170Gly) в гетерозиготном положении. У родителей пациентки мутация не обнаружена (мутация de novo). После достижения целевых значений АД и пульса на терапии альфа- и бета-адреноблокаторами проведена двусторонняя адреналэктомия, назначена заместительная терапия глюко- и минералокортикоидами. По данным патоморфологического исследования, подтверждена двусторонняя феохромоцитома (по шкале PASS слева — 2 балла, справа — 0 баллов). При обследовании в 13 лет не получено данных за рецидив феохромоцитом, нет прогрессии в размерах образований поджелудочной железы и не получено данных за их гормональную активность, других компонентов заболевания не обнаружено.
Заключение. Генетическая верификация синдрома Хиппеля-Линдау важна для пациента (при подтверждении диагноза требуется регулярное скрининговое обследование для выявления других компонентов) и генетического консультирования других членов семьи. Нами представлено описание как единственного в семье случая заболевания с мутацией de novo, так и семейного случая с установлением диагноза другому члену семьи.
АКТУАЛЬНОСТЬ. Адренокортикальный рак (АКР) — это редкая злокачественная опухоль коры надпочечников. В последние годы АКР рассматривается как гетерогенная группа заболеваний с различными патоморфологическими и геномными особенностями, что обуславливает вариабельность клинической картины и прогноза для пациентов. Несмотря на многочисленные молекулярно-генетические, патоморфологические и клинические исследования в настоящее время определение злокачественного потенциала новообразования надпочечника в клинической практике все еще затруднено и является одной из сложнейших задач прижизненной гистологической диагностики.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование были включены пациенты с новообразованиями надпочечников, получившие лечение в ФГБУ «НМИЦ эндокринологии» Минздрава России, а также консультативный операционный материал пациентов из других лечебных учреждений. У всех больных проведена адреналэктомия в период с 2005 по 2022 гг. Всего для исследования было отобрано 143 случая опухолей надпочечников. Все образцы опухолевой ткани верифицировали в соответствии с Международной гистологической классификацией опухолей надпочечника (ВОЗ, 2022). ИГХ исследование производилось на автоматическом иммуногистостейнере Leica BOND III (Германия) по стандартным протоколам, рекомендованным фирмой-производителем с использованием моноклональных первичных антител к маркёру клеточной пролиферации Ki-67 (MIB 1 Leica (Германия)) и фосфогистону H3 (PHH3).
РЕЗУЛЬТАТЫ. Проанализированы признаки с точки зрения их информативности в отношении диагностики АКР. На первом этапе выделен признак «размер опухоли более 10 см и/или масса опухоли более 200 г». При соответствии опухоли этим критериям гистологический диагноз соответствовал АКР в 100% случаев. На втором этапе выполнен анализ случаев с отрицательным значением данного критерия. В соответствии с ROC-анализом показателя Ki-67 у всех пациентов с Ki-67<5% и Ki-67≥11% установлен гистологический диагноз — адренокортикальная аденома (АКА) и АКР, соответственно. На заключительном этапе была построена математическая модель для дифференциальной диагностики АКР и АКА при значении Ki-67 от 5 до 10 включительно. В результате была получена регрессионная модель:
Z=– 0,018*Хразмер + 0,278*Хмитозы – 0,261*Хядерный полиморфизм + 0,297*Хпатологические митозы + 0,816*Хинвазия в капсулу + 0,565*Хнекрозы. P = 1 / (1 + ).
При р≥0,5 гистологический диагноз соответствовал АКР, при p<0,5 — АКА. Разработанная математическая модель показала 100% точность (95% ДИ: 96–100%) на обучающей и тестовой выборке.
ЗАКЛЮЧЕНИЕ. Создание новой модели улучшит точность диагностики, устраняя субъективность и трудности в толковании нынешних диагностических критериев. Эта модель отличается своей универсальностью для различных морфологических вариантов АКР. Применение данной системы повысит эффективность гистологической диагностики адренокортикальных опухолей.
Актуальность. Адренокортикальный рак (АКР) — редкая злокачественная эндокринная опухоль из клеток коры надпочечника с частотой встречаемости 0,7–2 случая на 1 млн населения в год. Из-за трудностей диагностики АКР обнаруживается уже на стадии метастазирования, что ограничивает возможности хирургического вмешательства и предполагает неблагоприятный прогноз. При этом прогноз крайне неоднороден и трудно предсказуем в клинической практике. Наблюдается большая вариабельность клинических проявлений, встречаются как вялотекущие, так и агрессивные опухоли. Наличие иммунных клеток в опухолевом микроокружении нередко ассоциировано с лучшим прогнозом для пациентов, однако учитывая разнонаправленность действия различных субпопуляций иммуноцитов на опухолевый рост, важно определить не только интенсивность, но и состав иммунного инфильтрата. Детальный анализ состава опухоль-инфильтрирующих иммунных клеток при АКР ранее не проводился.
Материалы и методы. В исследование были включены образцы опухолевой ткани от 71 пациента с классическим (n=36; 50,7%), онкоцитарным (n=18; 25,4%), миксоидным (n=9; 12,7%) и смешанным (n=8; 11,2%) вариантом АКР. Все образцы верифицировали в соответствии с Международной гистологической классификацией опухолей надпочечника (ВОЗ, 2022). Каждому из 71 пациента проведена серия иммуногистохимических окрашиваний на маркеры основных субпопуляций иммунных клеток: CD45, CD3, CD4, CD8 и CD68. Иммуногистохимический анализ срезов опухолевой ткани проводили по стандартной методике с помощью автоматического иммуногистостейнера Leica BOND III с использованием фирменных реактивов Leica. Было проанализировано влияние количества инфильтрирующих опухоль иммунных клеток с учетом паренхиматозного и стромального распределения на клинические исходы.
Результаты. Количество СD45+иммунных клеток в паренхиме и строме опухоли было относительно низким (189 и 268 клеток/мм2, соответственно). Однако количество иммунных клеток всех анализируемых популяций было выше в онкоцитарном (как в паренхиме так и строме опухоли) по сравнению с классическим вариантом АКР (р<0,001). Выявлено, что CD3+ Т-лимфоциты обильно представлены в паренхиме и строме классического и онкоцитарного вариантов АКР по сравнению с миксоидным вариантом. CD68+ макрофаги также были обнаружены во всех образцах опухолевой ткани, однако их количество было выше в онкоцитарном варианте по сравнению с классическим. Анализ взаимосвязи выживаемости с изучаемыми факторами показал, что общая выживаемость и выживаемость без прогрессирования между классическими и онкоцитарными гистологическими вариантами существенно различаются в пользу последнего (p><0,05). ЗАКЛЮЧЕНИЕ. Интенсивная иммунная инфильтрация является благоприятным прогностическим фактором при АКР. Изучение субпопуляционного состава микроокружения может быть использовано для прогнозирования исходов AКР. КЛЮЧЕВЫЕ СЛОВА: адренокортикальный рак; иммунное микроокружение; прогностическое значение> ˂ 0,001). Выявлено, что CD3+ Т-лимфоциты обильно представлены в паренхиме и строме классического и онкоцитарного вариантов АКР по сравнению с миксоидным вариантом. CD68+ макрофаги также были обнаружены во всех образцах опухолевой ткани, однако их количество было выше в онкоцитарном варианте по сравнению с классическим. Анализ взаимосвязи выживаемости с изучаемыми факторами показал, что общая выживаемость и выживаемость без прогрессирования между классическими и онкоцитарными гистологическими вариантами существенно различаются в пользу последнего (p ˂ 0,05).
Заключение. Интенсивная иммунная инфильтрация является благоприятным прогностическим фактором при АКР. Изучение субпопуляционного состава микроокружения может быть использовано для прогнозирования исходов AКР.
АКТУАЛЬНОСТЬ. Акромегалия — редкое нейроэндокринное заболевание, характеризующееся повышенной секрецией гормона роста, что способствует активной пролиферации клеток различных тканей в организме. Данная когорта пациентов подвержена повышенному риску возникновения новообразий, к самым частым относится колоректальный рак. Периваскулярная эпителиоидноклеточная опухоль (обычно называемая ПЭКома) — редко встречается, состоит из клеток, тип которых до сих пор остается неизвестным.
МАТЕРИАЛЫ И МЕТОДЫ. Представлен клинический случай пациентки с ПЭКомой и акромегалией.
РЕЗУЛЬТАТЫ. Пациентке А. в 2011 г. по клинической картине заподозрена акромегалия, специфическое лечение не получала. По данным МРТ головного мозга и уровню инсулиноподобного фактора роста-1 (ИФР-1), в 2015 г. выполнена трансназальная транссфеноидальная аденомэктомия. Через 2 года после операции на фоне беременности отмечался продолженный рост исходной макроаденомы гипофиза с охватом внутренней сонной артерии слева, в связи с чем после родов выполнена стереотаксическая хирургия по 8 Гр в 2 фракции и назначена терапия аналогами соматостатина длительного действия.
В 2018 г. впервые выявлена очаговая гиперплазия печени, при многократном обследовании — подозрение на метастазы в печень. Через год при серии МСКТ и МРТ исследований выявлено образование хвоста поджелудочной железы размерами до 2,2х1,65 см (с умеренно повышенным сигналом в DWI и незначительным накоплением контрастного вещества), 2 образования в печени (4 сегмент), проведена пункция образований под контролем УЗИ (гистологически не исключалось наличие эпителиальной опухоли на фоне гранулирующего воспаления). По данным иммуногистохимического исследования — гемангиома капиллярного типа.
В сентябре 2019 г. выполнена пункция образования в печени, определялись морфологические признаки холестаза, а также очаговая дистрофия гепатоцитов. Признаков метастазов злокачественной опухоли в микропрепаратах не обнаружено.
В ноябре 2020 г. при МСКТ органов брюшной полости и забрюшинного пространства выявлено образование в хвосте поджелудочной железы 25х18х21 мм.
В апреле 2022 г. проведены гемигепатэктомия (атипичная резекция 4, 5, 8 сегментов печени), холецистэктомия, дистальная резекция хвоста поджелудочной железы. По результатам биопсии операционного материала: образование поджелудочной железы соответствовало злокачественной опухоли из периваскулярных эпителиоидных клеток (ПЭКома), печени — гепатоцеллюлярный рак.
В феврале 2023 г. в связи с частичной резистентностью к аналогам соматостатина и отказом пациентки от повторного оперативного вмешательства, инициирована терапия пэгвисомантом. На фоне медикаментозной терапии достигнута нормализация уровня ИФР-1, роста образований органов брюшной полости по данным инструментальных исследований не отмечалось.
ЗАКЛЮЧЕНИЕ. Высокий риск различных новообразований при акромегалии может быть реализован у пациента с сочетанным проявлением редких опухолей, таких как гепатоцеллюлярный рак и ПЭКомы поджелудочной железы. Данный клинический случай демонстрирует необходимость своевременного лечения акромегалии и скрининга возможных онкологических заболеваний у этих пациентов.
Цель. Разработка методов культивирования трехмерных органоподобных культур (органоидов) рака щитовидной железы. Создание первой в мире коллекции живых раковых органоидных линий опухолей щитовидной железы человека.
Материалы и методы. Исходным материалом для линий органоидов были свежие образцы ткани папиллярного рака, полученные в результате хирургического удаления первичных опухолей и метастазов. Органоиды размножали in vitro и хранили в замороженном виде с возможностью разморозить живую культуру в любое время. Критически важными компонентами системы культивирования раковых органоидов являются: среда культивирования, внеклеточный матрикс для культивирования и метод предподготовки образца опухоли перед началом культивирования.
Результаты. Были получены органоиды папиллярного рака щитовидной железы (ПРЩЖ) как из первичных опухолей, так и из метастазов. Предварительная обработка раковой ткани, питательная среда, внеклеточный матрикс и способ пассирования имели решающее значение для успешного создания стабильных органоидных культур. Оптимизация всех этапов привела к получению самоподдерживающихся линий органоидов ПРЩЖ. Иммуногистохимические анализы (маркер пролиферативной активности Ki-67, тиреоидный фактор транскрипции TTF-1 и тиреоглобулин TG) и окрашивание гематоксилином-эозином органоидов и исходной опухолевой ткани подтвердили злокачественную природу органоидов, их гетерогенность и доказали, что органоиды ПРЩЖ повторяют морфологические и гистопатологические особенности (такие как папиллярные, фолликулярные или кистозные структуры) исходной опухолевой ткани. Анализы проводились по меньшей мере после трех пассажей органоидных линий РЩЖ in vitro. На более поздних пассажах культур органоидов обнаружены случаи клональной эволюции (снижение экспрессии тироглобулина) в пределах одной линии органоидов. Полученные данные могут указывать на увеличение злокачественного потенциала культуры и, предположительно, являются отражением естественного течения болезни у пациента in vivo.
Выводы. Полученные органоиды являются персонифицированной клеточной моделью ПРЩЖ и имеют потенциал для тестирования таргетной терапии ПРЩЖ, особенно радиойод-резистентных форм и при метастатическом поражении.
Актуальность. Анализ на основе компьютерной томографии является объективным и полезным инструментом для оценки саркопении, которая в большинстве случаев диагностируется еще до установления диагноза рака желудка, до начала проведения специального лечения и является одним из важных предикторов токсических осложнений противоопухолевой лекарственной терапии. В тоже время анализ результатов большого количества исследований подчеркивает значимость дисмикроэлементоза, как в процессе канцерогенеза, так и опухолевой прогрессии. Селен, медь, цинк и марганец являются неотъемлемыми компонентами антиоксидантной защиты клеток, а также детоксикации ксенобиотиков, в том числе противоопухолевых лекарственных средств.
Материалы и методы. Уровень содержания микроэлементов в плазме крови 100 больных, полученной до начала, а также после 4 курса полихимиотерапии с диагнозом «Рак желудка», II–IV стадий опухолевого процесса, разных возрастных групп, определяли с помощью спектрометра с масс-спектрометрическим детектированием Varian 810-MS. Для диагностики саркопении использовали компьютерную томографию. Для оценки саркопении определялась площадь мышечной ткани по двум последовательным аксиальным срезам, выполненным на уровне тела 3-го поясничного позвонка. Для оценки тяжести нежелательных явлений использовались общие критерии токсичности Национального института рака США (CTCAE v5.0). Статистический анализ полученных данных осуществлялся с применением статистического пакета Statistica 10.
Результаты. Исследование корреляционных связей путем определения коэффициента корреляции Спирмена (r) показало, что между скелетно-мышечным индексом (СМИ) до начала лечения и степенью тяжести анемии после 4 курса лечения имеется умеренная (r=-0,302), обратная, статически значимая связь (p<0,05); умеренная, обратная, статистически значимая связь, наблюдается между СМИ и степенью тяжести анемии (r=-0,323) и гипопротеинемии (r=-0,300) после 4 куров химиотерапии; СМИ до начала лечения коррелировал со степенью тяжести лейкопении и гипопротеинемии после 4 курса химиотерапии — где наблюдалась слабая (r=-0,292; r=-0,276), обратная, статистически значимая связь. Соотношение концентрации селен/марганец до начала лечения коррелировало со степенью тяжести анемии после 4 курсов ПХТ — где наблюдалась слабая (r=-0,249), обратная, статистически значимая связь, в то же время соотношение медь/цинк до лечения коррелировало со степенью тяжести лейкопении после 4 курсов ПХТ — где наблюдалась умеренная (r=-0,312), обратная, статистически значимая связь. Соотношение цинк/марганец и медь/ марганец до лечения коррелировало со СМИ после 4 курса лечения, где наблюдалась слабая (r=-0,240), обратная, статистически значимая связь. > ˂ 0,05); умеренная, обратная, статистически значимая связь, наблюдается между СМИ и степенью тяжести анемии (r=-0,323) и гипопротеинемии (r=-0,300) после 4 куров химиотерапии; СМИ до начала лечения коррелировал со степенью тяжести лейкопении и гипопротеинемии после 4 курса химиотерапии — где наблюдалась слабая (r=-0,292; r=-0,276), обратная, статистически значимая связь. Соотношение концентрации селен/марганец до начала лечения коррелировало со степенью тяжести анемии после 4 курсов ПХТ — где наблюдалась слабая (r=-0,249), обратная, статистически значимая связь, в то же время соотношение медь/цинк до лечения коррелировало со степенью тяжести лейкопении после 4 курсов ПХТ — где наблюдалась умеренная (r=-0,312), обратная, статистически значимая связь. Соотношение цинк/марганец и медь/ марганец до лечения коррелировало со СМИ после 4 курса лечения, где наблюдалась слабая (r=-0,240), обратная, статистически значимая связь.
Заключение. Результаты нашего исследования свидетельствуют о том, что совокупная оценка концентрации металлов и скелетно-мышечного индекса точнее предсказывает тяжелые осложнения противоопухолевой лекарственной терапии больных раком желудка.
Актуальность. Последнее десятилетие наблюдается значительное расширение спектра научных проблем онкоэндокринологии, как по содержанию, так и по используемым новейшим высокоточным методам исследования, во многом обеспечивающим персонификацию дальнейшей лечебной тактики. В классическом представлении содержательная часть направления включает изучение опухолей эндокринных органов и гормонозависимых неоплазий органов-мишеней.
Результаты (новые задачи). В настоящее время нарастающую актуальность приобретает изучение особенностей течения и коррекции исходных эндокринопатий на фоне комплексной или комбинированной противоопухолевой терапии при том или ином неопластическом процессе, а также в период его ремиссии. Вследствие высокой распространенности особое значение приобретает управление сахарным диабетом 2 типа, саркопеническим ожирением, тиреоидным статусом у онкологических больных на всех этапах лечения и реабилитации. Существует высокая потребность практического здравоохранения в утвержденных протоколах подготовки и ведения пациентов онкологического профиля с той или иной коморбидной эндокринопатией на фоне комплексной/комбинированной терапии, выполнения диагностических вмешательств и др.
Еще одним новым аспектом онкоэндокринологии является развитие обратимых и необратимых специфических поражений органов внутренней секреции, вызванных противоопухолевым лечением. Несмотря на то, что основное внимание исследователей в настоящее время направлено на изучение особенностей активации аутоиммунных процессов при применении иммуннотерапии, не меньшей актуальностью обладает уточнение токсического поражения эндокринных органов в результате химотерапевтического или таргетного лечения для разработки способов профилактики и коррекции. Изучение течения исходных эндокринопатий и развития токсических и лучевых поражений представляют собой новое научное направление онкоэндокринологии и важнейшую практическую задачу, решение которой позволит увеличить общую и, потенциально, безрецидивную выживаемость больных, учитывая пермиссивную роль большинства гормонов в онкогенезе.
Многие эндокринопатии являются факторами риска опухолевого роста (преимущественно дифференцированных эпителиальных опухолей). Таким образом, то или иное эндокринное заболевание (акромегалия, эндогенный гиперкортицизм, сахарный диабет 2 типа, ожирение, синдром поликистозных яичников, идиопатическая гиперандрогения у мужчин и др.) возможно рассматривать in vivo моделью роли гормонального сигналинга в онкогенезе, а национальный регистр эндокринопатий может служить основой для формирования регистра граждан высокого онкологического риска, подразумевающего омоложение и углубление скрининговых мероприятий на популяционном уровне и персонификацию профилактических мер с учетом других факторов риска на индивидуальном уровне. Одним из стратегических аспектов разработки мер первичной профилактики злокачественных опухолей, на наш взгляд, является объединение национальных канцер-регистра, регистра эндокринопатий и регистра вспомогательных репродуктивных технологий. Еще одной сложной нерешенной задачей, стоящей перед онкологами и организаторами здравоохранения, является разработка и внедрение системы мониторинга и учета токсических эффектов лечения пациентов онкологического профиля с целью управления и профилактики развития тяжелой токсичности. В настоящее время отсутствует единая система регистрации, анализа и управления токсическими эффектами лекарственного лечения у больных злокачественными новообразованиями, таким образом, затруднено проведение научных изысканий и организационных мероприятий.
Заключение. Решение новых задач онкоэндокринологии на государственном уровне, разработка и массовое внедрение принципов персонификации лечения пациентов является одним из основных вызовов к существующей модели управления научным и лечебным процессами и требует тесного сотрудничества между учреждениями онкологического, эндокринологического, акушерско-гинекологического профиля различных регионов России с созданием междисциплинарных рабочих научных групп на местах.
Актуальность. Инсулинома — наиболее частая причина эндогенного гиперинсулинизма (ЭГ), диагностика и лечение которой непростая задача в практике эндокринолога. Основным методом диагностики является тест с 72-часовым голоданием. Критерии постановки диагноза ЭГ: глюкоза<3,0 ммоль/л, инсулин плазмы ≥3,0 мкМЕ/мл (≥18 пмоль/л), С-пептид сыворотки ≥0,2 нмоль/л (≥0,6 нг/мл). Однако известно, что в редких случаях при инсулиноме уровень С-пептида в пробе с голоданием может быть меньше порогового значения. Представленный клинический случай демонстрирует трудности диагностического поиска у пациентки с инсулиномой и дискордантными результатами пробы с голоданием.> ˂ 3,0 ммоль/л, инсулин плазмы ≥3,0 мкМЕ/мл (≥18 пмоль/л), С-пептид сыворотки ≥0,2 нмоль/л (≥0,6 нг/мл). Однако известно, что в редких случаях при инсулиноме уровень С-пептида в пробе с голоданием может быть меньше порогового значения. Представленный клинический случай демонстрирует трудности диагностического поиска у пациентки с инсулиномой и дискордантными результатами пробы с голоданием.
Материалы и методы. Пациентка 57 лет с жалобами на приступы, сопровождающиеся клиникой гипогликемии, купирующиеся приемом легкоусвояемых углеводов, с прибавкой веса на 19 кг за 8 лет, поступила в отделение эндокринологии НМИЦ В.А. Алмазова в марте 2023 г.
Результаты. Амбулаторно при заборах крови на фоне гипогликемии отмечалось отсутствие адекватного подавления инсулина, однако уровень С-пептида был ниже порогового значения: 01.2021 г.: глюкоза плазмы 2,5 ммоль/л, С-пептид 0,181 нмоль/л, инсулин 7,92 мкМЕ/мл. 02.2021 г.: глюкоза 2,3 ммоль/л, инсулин 3,2 мкМЕ/мл, С-пептид 0,138 нмоль/л. Был сделан вывод об отсутствии данных за ЭГ, исключены другие причины недиабетической гипогликемии. По результатам компьютерной томографии (КТ) органов брюшной полости (ОБП), данных за образование поджелудочной железы (ПЖ) не получено.
Во время госпитализации проведена проба с 72-часовым голоданием: через 14,5 часа голодания глюкоза 2,46 ммоль/л, инсулин 24,8 пмоль/л, С-пептид 0,5 нг/мл. С учетом дискордантных результатов инсулина и С-пептида проба выполнена повторно в условиях ОРИТ для исключения артифициального введения инсулина: через 7 часов голодания глюкоза 2,05 ммоль/л, инсулин 32,1 пмоль/л, С-пептид 0,69 нг/мл. Таким образом, при повторном проведении пробы уровень С-пептида соответствовал критериям ЭГ, было принято решение о проведении топической диагностики инсулиномы. По данным позитронно-эмиссионной томографии-КТ с 68Ga-ДОТА-ТАТЕ, выявлено образование головки ПЖ с гиперэкспрессией соматостатиновых рецепторов 2 типа размерами 10х7 мм. По результатам магнитно-резонансной томографии (МРТ) ОБП: образование головки ПЖ размерами 11х8 мм. Была выполнена эндоскопическая ультрасонография с тонкоигольной аспирационной биопсией образования ПЖ, по результатам которой в головке ПЖ определялось образование размером до 2,0х1,5 см. По результатам цитологического и иммуноцитохимического исследований получены данные за нейроэндокринную опухоль (НЭО) с диффузной экспрессией инсулина, пролиферативная активность по Ki-67 до 0,5% (G1).
Пациентке выполнено хирургическое лечение в объеме панкреатодуоденальной резекции. По данным гистологического и иммуногистохимического исследования подтвержден диагноз: «НЭО ПЖ с экспрессией инсулина», рТ1N0, G1(Ki-67 0,2%) (инсулинома). После операции гипогликемии не рецидивировали. Период наблюдения составил 3 месяца. Пациентка жалоб не предъявляет, отмечает уменьшение потребности в легкоусвояемых углеводах, снижение веса на 15 кг.
Заключение. В редких случаях при инсулиноме могут быть дискордантные результаты пробы с голоданием. При исключении артифициального введения инсулина целесообразно проведение диагностического поиска, направленного на выявление источника автономной продукции инсулина.
Актуальность. Позитронно-эмиссионная компьютерная томография, совмещенная с МСКТ (ПЭТ-КТ), относится к гибридным методам инструментальной диагностики, при выполнении которой оцениваются как анатомические, так и функциональные особенности исследуемой области. В последнее время изучаются возможности ПЭТ-КТ с 11С-холином при визуализации аденом околощитовидных желез (ОЩЖ), которые являются наиболее распространенной причиной развития первичного гиперпаратиреоза (ПГПТ). В настоящее время клинические рекомендации по ПГПТ регламентируют использование следующих диагностических методов: ультразвуковое исследование (УЗИ), мультиспиральная компьютерная томография (МСКТ), двухфазная или субтракционная сцинтиргафия с 99mTc-МИБИ и 99mTc-пертехнитатом. Однако нередки случаи персистенции заболевания после проведения хирургического лечения ПГПТ. В связи с этим использование других методов топической диагностики ПГПТ может иметь большое значение в рамках улучшения качества визуализации аденом ОЩЖ на предоперационном этапе.
Материалы и методы. В исследование были включены 34 больных с биохимически подтвержденным диагнозом ПГПТ. Всем больным было выполнено УЗИ, МСКТ шеи и органов грудной клетки, субтракционная сцинтиграфия с 99mTc-МИБИ/99mTc-пертехнетатом и ПЭТ/КТ с 11С-холином. Впоследствии всем больным была выполнена ПТЭ. Результаты гистологического исследования принимались за «золотой стандарт» при оценке диагностической точности методов визуализации.
Результаты. Большинство больных ПГПТ составляли женщины (76%), медиана возраста составила 59 лет (55; 64). Всем больным выполнялась ПЭТ-КТ с 11С-холином в рамках топической диагностики ПГПТ. К настоящему времени 17 больным выполнена ПТЭ, по результатам гистологического исследования подтвердилось наличие аденомы/гиперплазии ОЩЖ у всех больных. Множественные аденомы/гиперплазии выявлены в 4 случаях (4/17; 29%). Эктопированные аденомы/гиперплазии были обнаружены в 4 случаях (4/17; 29%). УЗИ, МСКТ, субтракционная сцинтиграфия с 99mTc-МИБИ и 99mTc-пертехнетатом, ПЭТ-КТ с 11С-холином продемонстрировали следующие показатели чувствительности: 48%, 71%, 51% и 91% и специфичности: 56%, 78%, 83% и 94 %, соответственно.
Заключение. ПЭТ-КТ с 11С-холином продемонстрировала более высокие показатели чувствительности и специфичности по сравнению с другими методами визуализации аденом ОЩЖ, что делает использование данного метода привлекательным для топической диагностики ПГПТ.
Актуальность. Популяционные исследования клинических случаев предполагают наличие ассоциаций между ВДКН и развитием опухолей надпочечников [1]. Дефицит 21-гидроксилазы, опосредованный наличием мутаций в гене CYP21A2, является причиной развития врожденной дистрофии коры надпочечников (ВДКН) в 90–95% случаев. Ген CYP21A2 расположен внутри RCCX локуса на коротком плече 6-й хромосомы, содержащего более чем в 65% случаев псевдоген CYP21A2. Из-за гомологии между геном и псевдогеном около 96–98% сложность при анализе мутаций в гене CYP21A2 существенно возрастает. Высокая достоверность результатов генетического анализа является важнейшим фактором для диагностики и терапии патологических состояний, ассоциированных с геном CYP21A2.
Материалы и методы. С помощью метода ПЦР, с использованием набора LongAmp Taq PCR Kit, NEB амплифицировали участок 6179 bp (NC_000006.12), включающий в себя целевой полный ген CYP21A2, с праймеров CYP749f (AGGTGCTCCTGGTGGCTAAAGG) и Tena36F2 (AGGCGCTCGCTATGAGGTGAC). ПЦР-продукт очищали согласно инструкции производителя с применением магнитных частиц AMPure XP (Beckman Coulter). Очищенный ПЦР-продукт использовали для постановки сиквенсовой реакции и ПЦР в реальном времени (ПЦР-РВ). Cиквенсовую реакцию проводили с помощью BigDye Terminator v3.1 Cycle Sequencing Kit с 8 внутренних праймеров, универсальных для гена CYP21A2 и псевдогена CYP21A2P, перекрывающих кодирующие области гена CYP21A2. ПЦР-РВ использовали для детекции 9 частых мутаций (rs9378251, rs6475, rs6471, rs6445, rs7755898, rs7769409, rs12530380, rs1554299737, rs6476) с помощью собственной разработанной тест-системы на основе технологии TaqMan-зондов и 5x qPCRmix-HS (Евроген).
Результаты. Благодаря универсальности праймера CYP749f, расположенного в 5’-области перед геном CYP21A2 и псевдогеном CYP21A2P, и специфичности праймера Tena36F2, расположенного в 35 экзоне гена TNXB, в ходе ПЦР амплифицируется только участок локуса RCCX, предположительно содержащий транслируемую версию гена CYP21A2. При этом для анализа доступны химерные варианты с крупными делециями между геном и псевдогеном. Достоверность анализа 10 групп сибсов подтверждена методом секвенирования по Сэнгеру. Результаты, полученные методом ПЦР-РВ с использованием TaqMan-зондов на 84 образцах, согласуются с данными, полученными методом секвенирования по Сэнгеру в 100% случаев.
Заключение. Разработанные методики секвенирования по Сэнгеру и ПЦР-РВ с применением TaqMan-зондов позволяют обнаруживать мутации в транслируемых вариантах гена CYP21A2 как в норме, так и в случаях конверсий между геном и псевдогеном, либо в случаях крупных делеций с образованием химерных вариантов. Ограничением методик является неспособность детектировать аллели с крупными делециями, затрагивающими область отжига праймеров CYP749f или Tena36F2.
Актуальность. Опухоли головного мозга глиального ряда (ГОГМ) занимают до 60% всех новообразований головного мозга. Результаты лечения этой категории больных остаются крайне неудовлетворительными и не имеют тенденции к улучшению. По биологическим признакам роста, ГОГМ в большей степени являются местно-деструирующими и не дают метастазов. Высокая потенция к рецидивам сопровождается выраженным провоспалительным компонентом как в опухоли, так и в микроокружении. Воспаление является индикатором глубоких иммунных реакций как в месте патологии, так и на системном уровне. Одним из звеньев иммунного патогенеза могут быть состояния иммунореактивности аллергического типа. Однако до настоящего времени аллергостатус у больных ГОГМ изучен недостаточно. Этим определяется актуальность настоящего исследования.
Материалы и методы. Материалом для анализа стали показатели 571 общего анализа крови (ОАК), полученного у 31 больного глиальными опухолями головного мозга (ГОГМ). Женщин — 15, мужчин — 16. Средний возраст больных — 41,3±2,3 года (min 21 — max 63). Диагнозы: астроцитома — 17, глиобластома — 12, олигодендроглиома — 2. Интервал взятия анализов 8,4±1,7 дня. Время наблюдения за больными 90 дней. Спецификация аллергического статуса проведена по показателю индекса аллергизации (ИА) по формуле А.А. Солдатова (1997, 2002, 2004):
ИА= лимф%+10*(эоз%+1) / нейтр.%+мон.%+базоф%.
Статистическая обработка материала проведена по t-критерию Стьюдента. РЕЗУЛЬТАТЫ. Гипоаллергенное состояние зарегистрировано в 107 анализах (18,7%), норма — в 134 (23,5%), аллергизация — 330 (57,8%), соответственно. Средний показатель гипоаллергенных состояний составил 0,47±0,012 (min 0,17 — max 0,67), аллергизации 1,94±0,05 (min 1,09 — max 7,74), нормо-реактивность 0,9±0,01 (min 0,68 — max 1,08), соответственно. Статистически значимо определены различия в паре «гипо- и нормо-реативность» (pt<0,001 уровень надежности T>99,99%). В паре «аллергизация и нормо-реактивность» также зарегистрированы статистически значимые различия (pt<0,001 уровень надежности T>99,99%). Соответственно гипоаллергенные и аллергенные состояния также имеют статистически значимые различия.
Заключение. В 76,5% у больных глиальными опухолями головного мозга зафиксированы изменения в аллергическом статусе: в 18,7% — гипореактивность, в 57,8 % — аллергизация. Иммунная дезадаптация реакций аллергического типа является характерным биологическим признаком этих новообразований. Иммунологи вообще не принимают никакого участия в лечении этой сложной категории больных ни на каком этапе. Полученные данные заставляют задуматься о пересмотре принципов лечения больных ГОГМ.
Актуальность. Адренокортикальный рак (АКР) — редкая злокачественная опухоль коркового слоя надпочечника, характеризующаяся агрессивностью клинического течения и неблагоприятным лечебным прогнозом. Большая часть случаев АКР выявляется как инсиденталома надпочечника. Редкость АКР обуславливается объективными трудностями диагностики заболевания вне специализированных учреждений, в связи с чем актуальность проблемы ранней диагностики заболевания с помощью комплексного подхода в условиях клинико-диагностического центра очевидна.
Материалы и методы. В период с 09.2014 по 02.2020 гг. в условиях клинико-диагностического центра обследовано 667 пациентов с образованиями надпочечников, случайно выявленными в ходе визуализирующих методов исследования. Топическая диагностика опухолей надпочечников заключалась в проведении компьютерной томографии с использованием контрастного вещества, определением нативной плотности образования и вычислением абсолютного и относительного процента вымывания контраста. Для оценки злокачественного потенциала опухоли надпочечника были использованы качественные характеристики образования — размер опухоли свыше 4 см, быстрый рост опухоли (более 5 мм за 6 месяцев), образования с высокой нативной плотностью при компьютерной томографии (более 20 ед. Н), абсолютный процент вымывания контраста менее 60%, относительный процент вымывания контрастного вещества менее 40%. Согласно клиническим рекомендациям для исследования гормональной активности опухолей надпочечников были выполнены фракционированные метанефрины в суточной моче, утренний кортизол плазмы на фоне подавляющего теста с 1 мг дексаметазона, при наличии артериальной гипертензии — уровень калия и альдостерона крови, а также активность прямого ренина. Пациенты с высоким злокачественным потенциалом образований надпочечников были обследованы на наличие метастазирования адренокортикального рака и решение вопроса дальнейшей тактики лечения.
Результаты. В результате проведенного комплекса диагностических мероприятий у 58 пациентов из 667 были обнаружены образования надпочечников с высоким злокачественным потенциалом, в связи с чем выполнено оперативное лечение — робот-ассистированная адреналэктомия. Были выявлены следующие нозоологические формы — ганглионеврома — 1, миелолипома — 1, киста надпочечника — 6, макронодулярная гиперплазия надпочечника — 1, адренокортикальная аденома — 34, феохромоцитома — 7, метастаз рака почки — 2, адренокортикальный рак — 6, что подтверждено гистологическим исследованием новообразований. Гормональная активность образований надпочечников в виде функциональной автономной продукции кортизола выявлена у 2 пациентов с АКР. Данных за метастатическое поражение ни у одного участника исследования с адренокортикальным раком выявлено не было, что говорит в пользу благоприятного лечебного прогноза.
Заключение. Комплексный подход диагностики адренокортикального рака с использованием современных лабораторных и лучевых методов исследования в условиях клинико-диагностического центра позволил поставить своевременный диагноз у большинства пациентов на ранней стадии заболевания без развития осложнений.
Акткуальность. В процессе метаболизма триптофана у Pseudomonas Aeruginosa происходит образование HHQ (2-гептил-4-хинолон) и PQS (2-гептил-3-гидрокси-4-хинолон), которые выступают в роли хинолиновых регуляторов и играют важную роль в качестве индуктора экспрессии целого ряда генов, обеспечивая тем самым повышение вирулентности микроорганизма и усиление проявлений его негативных эффектов на организм-хозяин. В результате происходит угнетение иммунной системы и формирование воспалительных изменений в бронхах. Однако несмотря на эти факты, до сих пор не было предпринято попыток оценить характер изменения содержания HHQ и PQS Pseudomonas Aeruginosa в крови больных с раком легких и провести всесторонний анализ сдвигов с их стороны с изменением уровня иммуноглобулинов и VEGF в крови. Изучение этих вопросов и стало целью настоящего исследования.
Материалы и методы. В исследование были включены 40 больных немелкоклеточным раком легкого (НМРЛ): 22 мужского и 18 женского пола, и 23 здоровых донора (7 мужчин, 16 женщин). Среди больных I стадия НМРЛ была диагностирована у 4, II — у 11, III — у 15, IV — у 10 пациентов. В крови больных с помощью метода ВЭЖХ проведено количественное определение PQS и HHQ, анализ содержания иммуноглобулинов G, S IgA, а также VEGF методом твердофазного иммуноферментного анализа.
Результаты. Исследования показали, что содержание PQS в крови больных с раком легких вдвое выше, чем у контрольной группы обследованных. При этом уровень HHQ у них оставался неизменным. На фоне данного сдвига у больных выявлялось снижение уровня иммуноглобулинов IgG, а также повышение содержания sIgA и фактора роста VEGF в крови. Все эти сдвиги отражают вероятный эффект бактериального метаболита PQS на иммунный ответ организма-хозяина, его роль в регуляции острой фазы воспаления слизистых оболочек и выраженность тканевой гипоксии при раке легких.
Заключение. Принимая во внимание тот факт, что PQS в организме человека синтезируется только в процессе обмена триптофана бактериями Pseudomonas Aeruginosa, как постоянными представителями микрофлоры, можно прийти к заключению об усилении их роста в бронхах при раке легких. Независимо от причины появления подобного сдвига, его возникновение формирует предпосылки для отягощения течения основного заболевания и ухудшения его прогноза. Несомненно, что высказанные предположения о возможных причинах усиления продукции PQS и соответственно усилении роста Pseudomonas Aeruginosa в организме больных требуют проведения специальных исследований. Всестороннее их изучение позволит разработать принципиально новые подходы к терапии рака легких.
Актуальность. Получение клинически значимого количества функционально эффективных естественных клеток-киллеров (NK) является важной задачей для иммунотерапии онкологических заболеваний. Современные методы производства NK-клеток ограничены из-за трудностей масштабирования и лицензионных ограничений. Целью данного исследования являлась оценка уровня экспрессии поверхностных маркеров активации и пролиферативной активности NK-клеток здоровых доноров в процессе длительной экспансии в газопроницаемых биореакторных системах G-Rex.
Материалы и методы. Градиентным методом выделяли мононуклеарные клетки, содержащие, в т.ч. NK-клетки, из периферической крови 10 здоровых доноров по стандартной методике. Применяли два способа культивирования. В первом способе клетки культивировали без добавления фидерных клеток (ФК), во втором добавляли ФК линии TMDK-562-15. Процесс культивирования проводили в 6-луночных биореакторах G-Rex6M (Wilson Wolf, США) с площадью поверхности 10 см2 в полной питательной среде на основе RPMI-1640 с добавлением ИЛ-2 (ронколейкин, «БИОТЕХ», Россия), в условиях CO2 -инкубатора при температуре 37о С в течение 14 дней. Индекс пролиферации (ИП) определяли как отношение общего числа клеток на 14 день к количеству клеток до начала культивирования. Активацию экспансированных in vitro NK-клеток оценивали по уровням экспрессии поверхностных маркеров HLA-DR и CD38 методом проточной цитометрии на 0-е, 7-е и 14-е сутки культивирования (AMNIS Image Stream MkII, «Luminex», США). Статистический анализ осуществляли с помощью «MS Excel 2016».
Результаты. По полученным данным средний ИП NK-клеток на 14-е сутки культивирования в 1-м способе составил 32, во 2-м — 206. Экспансия NK-клеток в условиях активации IL-2 с ФК показывала увеличение NK-клеток до 96%. Рост этой же популяции также наблюдался и в клеточной культуре при культивировании с IL-2 до 21% (p<0,05). В группе №2 уровень экспрессии HLA-DR+ находился на уровне 80% на протяжении всего цикла культивирования, а в первой группе составил 74 и 66% на 7-е и 14-е сутки, соответственно. Доля CD38+ на 7-е и 14-е сутки в группе №2 составила 99 и 97%, соответственно. В 1-й группе процент активированных NK-клеток, экспрессирующих маркер CD38, был постоянен и в среднем составил 95%. ЗАКЛЮЧЕНИЕ. Показано, что GMP-совместимый метод в газопроницаемых биореакторных системах G-Rex в присутствии IL-2 и ФК позволяет получить большое количество активированных NK-клеток из периферической крови здоровых доноров, что указывает на их перспективное использование в клинических исследованиях. > ˂ 0,05). В группе №2 уровень экспрессии HLA-DR+ находился на уровне 80% на протяжении всего цикла культивирования, а в первой группе составил 74 и 66% на 7-е и 14-е сутки, соответственно. Доля CD38+ на 7-е и 14-е сутки в группе №2 составила 99 и 97%, соответственно. В 1-й группе процент активированных NK-клеток, экспрессирующих маркер CD38, был постоянен и в среднем составил 95%.
Заключение. Показано, что GMP-совместимый метод в газопроницаемых биореакторных системах G-Rex в присутствии IL-2 и ФК позволяет получить большое количество активированных NK-клеток из периферической крови здоровых доноров, что указывает на их перспективное использование в клинических исследованиях.
Актуальность. Существует несколько противоположных точек зрения в оценке эффектов воздействия ионизирующих излучений в низких и относительно низких дозах. Одни исследователи описывают существование позитивного действия малых доз облучения, когда их уровень граничит с природным, а именно наблюдается стимулирующее действие радиации, проявляющееся в увеличении частоты клеточных делений. Другие отвергают какие-либо особенности эффектов низких доз. Третьи указывают на повышенную опасность относительно низких доз для организма. Поэтому изучение проблемы влияния относительно низких доз радиации на организм на сегодняшний день остается актуальной. ЦЕЛЬ. Изучить чувствительность активированных и неактивированных лимфоцитов онкологических больных к относительно низким дозам ионизирующего излучения (1-8 Гр) в условиях in vitro.
Материалы и методы. Лимфоциты выделяли из периферической венозной крови 10 онкологических больных со злокачественными новообразованиями абдоминальной области (ЗНАО) по стандартной методике на градиенте плотности фиколла (ρ=1,077) путем центрифугирования при 2000 оборотов/мин, затем дважды отмывали PBS и культивировали в концентрации 1–2х106 кл/мл в среде на основе RPMI-1640 во флаконах в условиях CO2 -инкубатора при 37°С в течение трех дней. Для получения активированных лимфоцитов в среду для культивирования добавляли IL-2 и IL-15. Активированные и не активированные лимфоциты облучали до культивирования и на 3-й день. Для облучения лимфоциты переносили в 5 чашек Петри диаметром 35 мм. Первую чашку не облучали, а использовали в качестве контроля. Другие четыре чашки с лимфоцитами облучали электронами в дозе 1 Гр, 2 Гр, 4 Гр и 8 Гр на установке Philips SL-20, энергия пучка 6 МэВ. Облученные и необлученные лимфоциты помещали в инкубатор на 24 часа при температуре 37o С, после чего подсчитывали количество клеток, а также анализировали их жизнеспособность.
Результаты. Жизнеспособность лимфоцитов после выделения из периферической крови клеток была выше 98%. После 3 дней активации лимфоцитов in vitro жизнеспособность сохранялась у 97%, а пролиферативная активность увеличивалась в среднем на 20%. После облучения не активированных лимфоцитов дозой 1 Гр их жизнеспособность на следующий день снижалась в среднем до уровня 20%. У активированных лимфоцитов выживаемость составила 78±3%, что ниже контроля на 14%. При облучении активированных лимфоцитов дозой 2 Гр жизнеспособность составила 56±4%, при 4 Гр — 39±2%, а при 8 Гр — 23±5%. Выявлено, что уровень жизнеспособности активированных лимфоцитов менее 50% появляется при облучении дозой более 2 Гр.
Заключение. При проведении лучевой терапии онкобольным необходимо учитывать тот факт, что количество лимфоцитов в периферической крови после лучевого воздействия может снижаться при поглощенных дозах выше 2 Гр. Активация интерлейкинами популяции лимфоцитов больных ЗНАО существенно снижает чувствительность клеток к действию ионизирующего излучения.
Актуальность. Современные подходы лечения онкологических больных, включают в себя методы иммунотерапии, основанные на адоптивном переносе больному аутологичных или аллогенных клеточных препаратов на основе активированных T-лимфоцитов или NK-клеток. Для эффективной активации и экспансии NK-клеток необходимо длительное культивирование, которое может включать ко-стимулирующие факторы (цитокины, антитела) и/или фидерные клетки. Целью данного исследования явилась оценка пролиферативной активности и иммунофенотипа NK-клеток здоровых доноров в процессе длительной экспансии.
Материалы и методы. Мононуклеарные клетки выделяли из периферической крови 10 условно здоровых доноров по стандартной методике и кокультивировали с фидерными клетками линии TMDK-562-15 в течение 20 дней в полной питательной среде RPMI-1640 с добавлением ИЛ-2 (ронколейкин, «БИОТЕХ», Россия) во флаконах, в условиях СО2 -инкубатора при температуре 37о С. Подсчет клеток и жизнеспособность осуществляли на автоматическом анализаторе TC10 (BioRad, Сингапур) каждые 10 дней. Индекс пролиферации (ИП) определяли как отношение общего числа клеток на 20 день к количеству клеток до начала культивирования. Цитофлуориметрический анализ проводили на 0, 10 и 20 дни экспансии на проточном цитометре с визуализацией Image Stream MkII («Luminex», США). Применяли 6-цветную панель меченых антител к СD45/3/56/16 и маркерам активации CD38/HLA-DR («BD Biosciences», США). Статистический анализ осуществляли с помощью «MS Excel 2016».
Результаты. Средний ИП NK-клеток на 20 день культивирования составил 106. В процессе экспансии происходила перегруппировка основных популяций NK- и T-клеток. На 20 день культивирования среднее содержание NK-клеток увеличилось в 11 раз до 86,7% (p<0,05), а Т-клеток снизилось в 6 раз до 12,8%. При этом более 70% NK-клеток имели фенотип CD56+CD16+, также наблюдалось увеличение экспрессии маркеров активации CD38+ и HLA-DR+ до 97,3% и 94,5% соответственно, что подтверждает процесс активации in vitro. ЗАКЛЮЧЕНИЕ. Показано, что длительное культивирование мононуклеарных клеток в присутствии цитокина и фидерных клеток позволяет многократно увеличить количество и долю активированных NK-клеток. Данную технологию можно использовать для производства клеточного продукта и получения CAR-NK-клеток.> ˂ 0,05), а Т-клеток снизилось в 6 раз до 12,8%. При этом более 70% NK-клеток имели фенотип CD56+CD16+, также наблюдалось увеличение экспрессии маркеров активации CD38+ и HLA-DR+ до 97,3% и 94,5% соответственно, что подтверждает процесс активации in vitro.
Заключение. Показано, что длительное культивирование мононуклеарных клеток в присутствии цитокина и фидерных клеток позволяет многократно увеличить количество и долю активированных NK-клеток. Данную технологию можно использовать для производства клеточного продукта и получения CAR-NK-клеток.
Актуальность. Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу новообразований, обладающих биологически активными свойствами и происходящих из нейроэндокринных клеток эмбриональной кишки. НЭО встречаются во всех органах, имеющих нейроэндокринные клетки. Наиболее частая их локализация — органы пищеварительного тракта и поджелудочная железа. Задачей лечения больных с НЭО является как ликвидация самой опухоли, так и подавление симптомокомплекса, обусловленного карциноидным синдромом. Важную роль в лечении функционально активных НЭО ЖКТ играют аналоги соматостатина, которые подавляют секрецию гормонов и пептидов, уменьшают секрецию и моторику желудка, внешнюю и внутреннюю секрецию поджелудочной железы, обладают антипролиферативными и другими эффектами. ЦЕЛЬ. Оценить эффективность применения аналогов соматостатина длительного действия у пациентки с нейроэндокринными опухолями поджелудочной железы.
Материалы и методы. Анализ данных пациентки с генетически подтвержденным синдромом множественных эндокринных неоплазий 1 типа (гетерозиготная мутация с.15541561 incC p p.P521fsX535), проходившей ежегодное стационарное лечение в ФГБУ «НМИЦЭ» до и после хирургического лечения по поводу НЭО поджелудочной железы, с оценкой назначенной терапии.
Результаты и обсуждение. Пациентка С. 42 года страдает язвенной болезнью желудка, эрозивным гастритом с 2004 года. В 2006 стали беспокоить приливы, избыточное потоотделение, профузная диарея, тошнота и рвота сразу после еды, по ЭГДС диагностировано желудочное кровотечение. В 2009 году выявлены множественные образования поджелудочной железы, диагностирован синдром Золлингера-Эллисона (гастрин без отмены ингибиторов протонной помпы 49 пмоль/л, после 2-х дневной отмены натощак 46,1 пмоль/л (1–10), 15 мин после еды 46,3 пмоль/л (5–30), через 30 мин после еды 46,1 пмоль/л (5–30), через час после еды 46,3 пмоль/л (5–30)). В октябре 2009 г. проведена сцинтиграфия с In-111-октреотидом, результаты показали наличие активной нейроэндокринной опухолевой ткани с высокой экспрессией соматостатиновых рецепторов в головке поджелудочной железы. По данным анализа крови уровень хромогранина А 1040,1 нг/мл (1–100). С ноября 2009 инициирована терапия октреотидом-депо 30 мг 1/мес. В феврале 2010 года в ЭНЦ проведена энуклеация трех опухолей головки поджелудочной железы, дистальная резекция хвоста поджелудочной железы с тремя опухолями, спленэктомия, холецистэктомия, по данным морфологического исследования: эндокринная опухоль солидно-трабекулярного строения с умеренным фиброзом стромы без окружающих тканей, метастаз высокодифференцированной эндокринной карциномы солидно-трабекулярного строения с умеренным фиброзом стромы в лимфатическом узле. В послеоперационном периоде проведено исследование на хромогранин А 13,9 Ед/л (2–18), серотонин 250,9 нг/мл (30–200); 5-ОИУК 11 мкмоль/сут; при сцинтиграфии с In-111-октреотид (на фоне отмены соматостатина): данных за наличие очагового процесса с активными соматотропными рецепторами не получено. Терапия октреотидом-депо отменена.
С июля 2012 года стала ощущать «карциноидные кризы», проявляющиеся приливами жара, гиперемии лица, приступами головокружения, в связи с чем возобновлена терапия октреотидом продленного действия 30 мг/28 дней, на фоне приема которого приливы купировались. Однако прием препарата был нерегулярный, и при длительном перерыве симптомы возобновлялись. При МСКТ в октябре 2012 г. выявлен очаг небольших размеров в области головки поджелудочной железы без клинических признаков синдрома Золлингера-Эллисона, что могло соответствовать рецидиву аденокарциномы, но при проведении сцинтиграфии с Тс-99 текратидом всего тела в этом очаге выявлена высокая активность соматотропных рецепторов, что позволило его классифицировать как нейроэндокринную опухоль. В дальнейшем на фоне продолжающегося лечения октреотидом продленного действия ежегодно проходила клиническое обследование и МСКТ-контроль брюшной полости, которое не выявило отрицательной динамики.
В 2017 г. при перерыве в приеме октреотида в течении 3–4 месяцев отмечалось возобновление карциноидного синдрома.
При МСКТ органов брюшной полости в декабре 2019 г. зарегистрировано увеличение количества объемных образований поджелудочной железы, на основании чего произведена замена октреотида на ланреотид в дозе 120 мг 1 раз в 28 дней.
В последующие госпитализации в 2021 г. и 2022 г. отмечалось отсутствие отрицательной динамики по данным МСКТ органов брюшной полости и забрюшинного пространства.
Выводы. Таким образом, на примере клинического случая представлена эффективность и безопасность длительного использования пролонгированных форм аналогов соматостатина Пациенты с нейроэндокринными опухолями испытывают проявления гормональной гиперсекреции, включающие диарею, приливы и бронхоспазм, которые существенно ухудшают качество жизни, а лечение аналогами соматостатина длительного действия значительно облегчает эти симптомы. Кроме того, антипролиферативный эффект аналогов соматостатина обеспечивает стабилизацию роста опухоли. Применение данных препаратов целесообразно в симптоматической и поддерживающей терапии, что открывает дополнительные возможности лекарственного лечения онкологических больных.
Актуальность. За последние 10 лет ингибиторы иммунных контрольных точек (иИКТ) прочно вошли в клиническую практику по причине их высокой эффективности в лечении злокачественных опухолей и удовлетворительного профиля токсичности. В результате действия иммунотерапии (ИТ) сверхактивированные иммунные клетки, наряду с противоопухолевым эффектом, могут вызывать аутоиммунные повреждения различных органов и систем. Среди нежелательных явлений (НЯ) наиболее часто встречаются нарушения функции ЖКТ по типу гастроэнтероколита и диареи (0,7–45%), а также иммуноопосредованные эндокринопатии (7–37,8%): нарушения функции щитовидной железы (до 50%), гипопитуитаризм (до 17%), сахарный диабет (до 1%), первичная надпочечниковая недостаточность (до 0,1%), гипопаратиреоз и аутоиммунные полигландулярные синдромы (единичные случаи).
Материалы и методы. Мы представляем клинический случай иммуноопосредованных эндокринопатий у пациентки с диссеминированным немелкоклеточным раком легкого (НМРЛ) на фоне терапии анти-PD-1 агентом ниволумабом с полным ответом на лечение, несмотря на сложность клинической ситуации и исчерпанность терапевтических резервов.
Результаты. Пациентке О. 58 лет 08.2019 установлен диагноз «Центральный рак (PD-PL-1 негативная аденокарцинома без активирующих мутаций) левого легкого cT4N3M1, IV стадия». Суммарно проведено 4 линии противоопухолевой терапии с включением таксанов, платиновых агентов, бевацизумаба, пеметрекседа, гемцитабина с максимальным эффектом в виде стабилизации процесса. В связи с очередным прогрессированием по данным контрольного обследования от 11.2022 с 12.2022 инициирована 5-я линия лечения — ИТ ниволумабом по 240 мг/14 дней. До начала ИТ эндокринных заболеваний в анамнезе не выявлено. После 7 курса 05.2023 развился деструктивный тиреоидит, гипотиреоидная фаза (ТТГ — 82 мМЕ/л, св.Т4-0,67 пмоль/л), назначен левотироксин натрия 100 мкг/сут, противоопухолевая терапия продолжена. 06.2023 в связи с жалобами на снижение АД до 90/60 мм рт. ст., общую слабость, тошноту и периодическую рвоту выполнено лабораторное исследование крови: АКТГ (утро) — 827 пг/мл, кортизол (утро) — 2,8 нмоль/л, ренин — 184 мкМЕ/мл, Na — 135 ммоль/л , K — 5,1 ммоль/л, ТТГ — 22 мМЕ/л. Диагностирована первичная надпочечниковая недостаточность (ПНН), назначена терапия: гидрокортизон 15 мг утром, 10 мг в 16:00+флудрокортизон 0,1 мг утром. На фоне терапии симптомы тошноты и рвоты купированы, АД нормализовалось. После компенсации ПНН доза левотироксина натрия была эскалировала до 125 мкг/сут, вследствие чего достигнута компенсация гипотиреоза (ТТГ — 0,4 мМЕ/л). Суммарно пациентке проведено 18 курсов ИТ. По данным контрольного ПЭТ-КТ с 18F-ФДГ и в/в йодсодержащим контрастированием от 10.2023: сохраняется полный метаболический ответ на лечение, данных за наличие активной опухолевой ткани не получено.
Заключение. Продемонстрирован клинический случай полного ответа на 5-ю линию терапии ниволумабом пациентки с диссеминированным НМРЛ. Пятилетняя выживаемость таких пациентов не превышает 5%, в связи с чем данный эффект можно назвать фантастическим. Все чаще в научных исследованиях сообщается об увеличении общей выживаемости и выживаемости без прогрессирования у пациентов с возникшими иммуноопосредованными эндокринопатиями в результате ИТ. Однако причины данной корреляциидо сих пор остаются неизвестными. Предполагаемая гипотеза требует дополнительных исследований для возможного определения данных осложнений как предикторов высокой эффективности терапии иИКТ и/или прогностических факторов более благоприятного течения опухолевого заболевания. Также данный клинический случай демонстрирует актуальность настороженности в отношении эндокринопатий среди онкологических пациентов с целью своевременной диагностики жизнеугрожающих состояний, таких как надпочечниковая недостаточность.
Актуальность. Реакция трансплантата против хозяина (РТПХ) является серьезным осложнением после аллогенной трансплантации костного мозга (алло-ТГСК) у пациентов со злокачественными заболеваниями крови. Терапией первой линии при развитии данного состояния является применение глюкокортикоидных гормонов (ГКС), однако только половина пациентов отвечают на стандартную терапию. При отсутствии клинического ответа на ГКС регистрируется стероид-рефрактерное течение РТПХ (СР-РТПХ), которое требует усиления иммуносупрессивной терапии (ИСТ) другими препаратами. Влияние этих препаратов на реципиента может также повлиять на результат терапии, в том числе оказывать негативное влияние на выживаемость и противолейкемический ответ. Определение точной выживаемости (ОВ и БРВ) пациентов с СР-РТПХ может быть сложным из-за небольшого количества исследований и разнообразия когорт пациентов.
Цель и задачи. Изучить влияние фактора стероидрефрактерности РТПХ на результат алло-ТГСК от неродственных доноров у детей со злокачественными заболеваниями кроветворной системы.
Материалы и методы. Проведен ретроспективный анализ 143 неродственных алло-ТГСК в период с 2003 по 2019 гг., у детей со злокачественных заболеваний крови: 100 при миелоидных опухолях и 43 при опухолях лимфоидной системы. Среди пациентов 69% (n=99) — мальчики и 31% (n=44) — девочки; средний возраст — 8,0 года (от 8 мес. до 17 лет). Костный мозг у 72% (n=103) пациентов, периферические стволовые клетки у 38% (n=40). HLA — совместимость: 10/10 в 77% (n=110), 9/10 в 23% (n=33). Медиана наблюдения 75,8 мес. (95% ДИ 65,7–82,9). РЕЗУЛЬТАТЫ. Частота развития ОРТПХ составила 69% (n=99), из них СР-РТПХ в 33% (n=33). ОВ пациентов всей когорты составила 57,3%, безрецидивной выживаемости (БРВ) 53,8%. При этом фактор развития ОРТПХ, на результаты статистически значимого влияния не оказал. ОВ в течении 5 лет у пациентов с ОРТПХ и без этого осложнения оказалась 62,1 и 53,1%, соответственно (р=0,58). Аналогичная тенденция наблюдается при анализе 5-летней БРВ — 59,2% и 49,8%, соответственно (р=0,5). При этом развитие СР-РТПХ показало статистически значимое различие по показателям долгосрочной ОВ и БРВ. Так, 5-летняя ОВ при СР-РТПХ — 38%, без осложнения 64,7% (р=0,0014), 5-летня БРВ при СР-РТПХ — 36,8%, без регистрации осложнения — 59,5% (р=0,006).
Заключение. ОРТПХ является второй из причин смертности после алло-ТГСК, ограничивающее ее применение. Однако, как показали результаты данного исследования, регистрация СР-РТПХ достоверно может быть ассоциированная с увеличением рисков смерти и рецидива заболевания у детей со злокачественными заболеваниями кроветворной системы после алло-ТГСК от неродственного донора. Оптимизация стратегии иммуносупресии, выявление факторов риска, позволит снизить частоту трансплантат-ассоциированной летальности и рецидивов гемобластозов.
Актуальность. Около 5% случаев апластической анемии АА может наблюдаться после аутоиммунного гепатита (АИГ). Ассоциированная с гепатитом, или постгепатитная апластическая анемия (ПГАА) представляет собой вариант АА, при котором недостаточность костного мозга следует за острым приступом гепатита менее чем через 6 месяцев от постановки диагноза АИГ. Интерферон-γ, продуцируемый Т-клетками, и последующие цитокиновые каскады становятся вовлечеными в патогенез ПГАА. Это указывает на то, что АА и гепатит имеют один и тот же механизм, при котором запускается Т-клеточно-опосредованный иммунный процесс.
Материалы и методы. Пациент И., мальчик 7 лет, дебют заболевания был в 2012 году, с клиники холестаза, гиперферментемии с проявлениями цитолиза. Выполнена биопсия печени, МРТ брюшной полости: у ребенка диагностирован аутоиммунный серонегативный гепатит на фоне первичного склерозирующего холангита. Проводилась терапия, согласно рекомендациям Европейской ассоциации по изучению печени (EASL): преднизолон 30 мг/сут внутривенно, с положительной динамикой, снижением уровня билирубина, трансаминаз. С 2013 по 2017 г. все показатели были в норме. В июле 2018 г. впервые выявлена изолированная цитопения, уровень ферментов печени был в норме, поскольку пациент был бессимптомным, выбран наблюдательный подход в качестве основной тактики. В октябре 2018 г. желтушность, выраженная слабость, прогрессирующая цитопения, определялись маркеры цитолиза. Биопсия костного мозга: аплазия. Кортикостероидная терапия аутоиммунного гепатита не проводилась. Было принято решение о проведении алло-ТГСК от идентичного сибса. Кондиционирование включало: циклофосфамид 100 мг/кг + флюдарабин 100 мг/м2 + антитимоцитарный иммуноглобулин 100 мг/кг + ритуксимаб 375 мг/м2 . Профилактика РТПХ (реакция «трансплантат против хозяина»): циклоспорин А (ЦсА) + микофеноловая кислота (ММФ). Функция трансплантата зарегистрирована на +24 день, отсутствует трансфузионная зависимость, полный донорский химеризм определялся с +100 дня после алло-ТГСК (95% клеток донора). В позднем посттрансплантационном периоде отмечалось повышение уровня трансаминаз и общего билирубина сыворотки. Данное состояние было расценено как РТПХ с поражением печени, в терапии конверсия ЦсА на такролимус (Такро), с положительным эффектом. Гемограмма оставалась нормальной.
Обсуждение. При анализе данного случая обнаружено достаточно редкое течение серонегатичного АИГ у ребенка, с двумя эпизодами активности с интервалом в 6 лет, а также нетипичная клиника развития апластической анемии на фоне аутоиммунного гепатита. Прогноз ПГАА согласно современным публикациям благоприятен только при проведении своевременной диагностики и терапии. После серонегативного гепатита необходимо контролировать показатели гемограммы и при наличии минимальной цитопении больных направлять в гематологический стационар. Данный вывод следует из нашего случая, когда динамическое наблюдение за больным согласно клиническим рекомендациям АИГ не предотвратило развитие жизнеугрожающего синдрома костномозговой недостаточности.
Актуальность. В последние годы все чаще в практике эндокринолога встречаются патологии, вызванные первичным аутоиммунным поражением эндокринных желез. При этом у многих пациентов формируется их недостаточность с частотой 2–5 на 100 000 населения. Но все же полиэндокринопатии, вызванные аутоиммунным повреждением, явление редко встречаемое. Поэтому каждый такой клинический случай вызывает интерес. В 1926 г. М. Шмидт подробно описал синдром одновременного поражения надпочечников (гипокортицизм) и щитовидной железы. Встречается в 3–8 раз чаще у женщин.
Результаты. Пациентка А.М., 1961 г. р. с жалобами на слабость, усиливающуюся при нервном стрессе, в период острых инфекционно-вирусных заболеваний. Из анамнеза: обратила внимание на очаговую пигментацию на лице, на коже передней поверхности грудной клетки; одновременно ощущала сильный упадок сил, тошноту, похудела с 61 до 53 кг при нормальном аппетите. В результате обследования участковым терапевтом: АКТГ — 1833 пг/мл; кортизол — 85 нмоль/л; глюкоза — 107,6 мг/дл. Общий анализ крови в норме. В связи с данными показателями пациентка была направлена на консультацию эндокринолога. Было проведено более расширенное обследование: данные рентген-снимка легких — без отклонений, МРТ надпочечников — в пределах нормы. Общий анализ крови без особенностей, АКТГ 1514 пг/мл, кортизол в 09:00 — 7,35 нмоль/л, кальций 2,4 нмоль/л, натрий 143 ммоль/л, калий 4,68 нмоль/л, ренин 87,1 пг/мл. Был поставлен диагноз «Болезнь Аддисона», назначен кортеф 10 мг утром. На фоне терапии состояние НЕЗНАЧИТЕЛЬНО улучшилось — слабость уменьшилась, но не исчезла, пигментация менее выраженная, прибавила в весе 7 кг за 6 месяцев. Терапия продолжалась в течение 11 месяцев. Несмотря на определенные улучшения, состояние продолжало вызывать беспокойство. В связи с этим пациентка обратилась в эндокринное отделение Терапевтической клиники Медицинского университета для коррекции терапии. При осмотре: рост 157 см, вес 60 кг, кожные покровы равномерно бронзовой окраски, обычной влажности. Подкожно-жировой слой распределен равномерно. Щитовидная железа не увеличена, неоднородной консистенции, безболезненная, подвижная. По органам — без патологии. АД 110/65 мм рт.ст., пульс 62 уд/мин. Наследственность не отягощена, 2 детей, менопауза с 47 лет. На момент обращения были проведены следующие исследования: АКТГ>1250 пг/мл; кортизол <1,00 нмоль/л, ренин 92,5 пг/мл; калий — 4,04 ммоль/л; кальций — 8,8 мг/дл, натрий 139 ммоль/л; глюкоза — 93 мг/дл; ТТГ 93,095 мЕд/л, св.T4 0,52 нг/дл; анти-ТПО 267 МЕ/мл.На основании комплексного подхода при обследовании данной пациентки выявлен диагноз: «Синдром Шмидта (хроническая первичная надпочечниковая недостаточность, гипотиреоз)». Корректировка назначений относительно уточненного диагноза: кортеф 10 мг в 08:00, 5 мг в 14.00; кортинефф 100 мг утром, эутирокс 75 мкг утром натощак. Даны рекомендации по изменению терапии на случай присоединения интеркуррентных заболеваний. ВЫВОДЫ. При определении у пациентов патологии, обусловленной аутоиммунным повреждением, рекомендуется комплексный подход в дополнительных исследованиях по выявлению возможных компонентов аутоиммунного полигландулярного синдрома. Что дает возможность более правильной и качественной коррекции патологии в целом, улучшая качество жизни пациента. >˂ 1,00 нмоль/л, ренин 92,5 пг/мл; калий — 4,04 ммоль/л; кальций — 8,8 мг/дл, натрий 139 ммоль/л; глюкоза — 93 мг/дл; ТТГ 93,095 мЕд/л, св.T4 0,52 нг/дл; анти-ТПО 267 МЕ/мл.На основании комплексного подхода при обследовании данной пациентки выявлен диагноз: «Синдром Шмидта (хроническая первичная надпочечниковая недостаточность, гипотиреоз)». Корректировка назначений относительно уточненного диагноза: кортеф 10 мг в 08:00, 5 мг в 14.00; кортинефф 100 мг утром, эутирокс 75 мкг утром натощак. Даны рекомендации по изменению терапии на случай присоединения интеркуррентных заболеваний.
Выводы. При определении у пациентов патологии, обусловленной аутоиммунным повреждением, рекомендуется комплексный подход в дополнительных исследованиях по выявлению возможных компонентов аутоиммунного полигландулярного синдрома. Что дает возможность более правильной и качественной коррекции патологии в целом, улучшая качество жизни пациента.
Актуальность. Апластическая анемия — редкое заболевание системы крови. Проявляется панцитопенией, аплазией костного мозга, связанной с нарушением иммунных механизмов регуляции кроветворения, количественным дефицитом и функциональными дефектами гемопоэтических стволовых клеток. АА развивается в результате подавления пролиферации гемопоэтических клеток-предшественниц активированными Т-лимфоцитами и естественными киллерами. Аутоиммунный генез апластической анемии при наличии подтвержденного диагноза СКВ не вызывает сомнений.
Материалы и методы. Девочка Х, от 2-й беременности, от первых срочных самостоятельных родов. До года психомоторное развитие по возрасту. Впервые жалобы на снижение активности ребенка, задержку моторного развития появились в возрасте 9 месяцев. В возрасте 1 года — регресс моторных функций, установлен диагноз: «Энцефалопатия смешанного генеза, синдром ДЦП (спастический тетрапарез)».
В возрасте 7 лет, после ОРВИ, при обследовании: лейкоцитоз, тромбоцитоз, гипопротеинемия, гипоальбуминемия, гиперхолестеринемия, азотемия, протеинурия, гематурия. Установлен диагноз: «Острый гломерулонефрит, нефротический синдром». При госпитализации в федеральный центр для верификации диагноза проведена нефробиопсия, по результатам которой морфологическая картина соответствовала мезангиокапиллярному гломерулонефриту (lupus-нефриту V класса), серологически негативному. В возрасте 14 лет у пациентки впервые выявлена панцитопения. По данным обследования: апластический костный мозг, ПНГ-клон не обнаружен, ДЭБ-тест — отрицательный, генетические аномалии не обнаружены, трепанобиопсия-аплазия кроветворения. Установлен диагноз «Апластическая анемия, сверхтяжелая форма». Проведен курс иммуносупрессивной терапии АТГАМ в комбинации с ингибиторами кальциневрина, стимуляцией нейтропоэза препаратами G-CSF. Гематологический ответ не достигнут, с учетом тяжелой сопутствующей патологии единственным методом лечения являлась аллогенная трансплантация гемопоэтических стволовых клеток. Кондиционирование перед ТГСК включало: ТАО 2 грей, тимоглобулин, флударабин, мельфалан, циклофосфамид. В качестве источника ГСК были использованы мобилизированные периферические стволовые клетки от полностью совместимого (10/10) неродственного донора. Восстановление гемопоэза на +19 сутки от алло-ТГСК. В посттрансплантационном периоде: тяжелые инфекционно-токсические и иммунные осложнения: орофарингеальный мукозит, двусторонняя полисегментарняя пневмония, респираторный дистресс-синдром, ТМА, аденовиремия, ЦМВ-виремия, ННV-6 виремия, о.РТПХ интестинальная форма.
Общий химеризм оставался полностью донорским.
Ухудшение состояния отмечено на +177 сутки: появление герпетической сыпи на губах, с реактивацией интестинальной формы РТПХ. Затем присоединилась дилатационная кардиомиопатия, надпочечниковая недостаточность, гипофункция трансплантата с трансфузионной зависимостью. В исходе панцитопении сепсис, приведший к смерти пациентки.
Обсуждение. Данный клинический случай — пример агрессивного течения СКВ, приведшей к развитию осложнений: хронический гломерулонефрит, приобретенная апластическая анемия. ТКМ — метод лечения, способный дать пациентам годы жизни и уменьшение агрессивности проявлений СКВ. Прогноз такого заболевания благоприятен только при тщательной курации пациента, правильно подобранной иммуносупрессивной, противомикробной, сопроводительной терапии и реабилитации.
Актуальность. К настоящему времени установлено более 100 генов, которые связаны с ожирением. Очевидная роль среди них принадлежит генетическому полиморфизму ферментов, участвующих в метаболизме липидов, к числу которых относится параоксоназа-1 (PON-1) имеющая тканеспецифическую локализацию в организме. Экспрессия различных вариантов гена PON-1 (полиморфизм rs662) сопровождается изменением активности параоксоназы в крови. Фермент проявляет лактоназную, пероксидазную и арилэстеразную активность. Он принимает участие в распаде перекисей липидов, в том числе содержащихся в составе ЛПВП. Параоксоназа катализирует гидролиз триацилглицеролов (ТАГ) в составе ЛПНП. С подобными свойствами связаны его антиоксидантный эффект, а также противовоспалительное и антисклеротическое действие. Однако до настоящего времени все еще остается не ясным характер взаимоотношения полиморфизма PON-1 с показателями липидного обмена и эндокринной функции мезенхимальных тканей в детском и подростковом возрасте. В этой связи целью данного исследования явилось изучение взаимосвязи полиморфизма PON-1 (rs662) с характером сдвигов в содержании адипокинов, миокинов и показателей липидного обмена в крови у детей и подростков разного пола с ожирением.
Материалы и методы. У 100 здоровых детей и подростков разного пола и 100 их сверстников с ожирением было проведено генетическое исследование по оценке однонуклеотидного полиморфизма гена PON-1 (rs662). В сыворотке крови проводилось определение показателей липидного обмена, активности аминотрансфераз (аланинаминотрансферазы и аспартатаминотрансферазы), а также лептина, адипонектина, резистина, апелина, ирисина, адипсина, миостатина, FGF21, остеокрина и онкостатина методом мультиплексного ИФА, а также аспросина — иммуноферментным методом.
Результаты. У гомозигот по аллели Arg192 ограничивается развитие осложнений ожирения у мальчиков и предупреждается их возникновение у девочек. При других вариантах генотипа PON-1 (генотипы Gln192/Gln и Gln192/Arg) в организме девочек формируются защитные механизмы, направленные на предупреждение осложнений при ожирении и их выраженности. У мальчиков с генотипом Gln192/Gln при ожирении выявляются более выраженные сдвиги со стороны показателей липидного обмена, проявления альтерации и увеличение массы жировой ткани, а у детей и подростков с гетерозиготным генотипом Gln192/Arg, усиливаются процессы атерогенеза.
Заключение. Результаты проведенных исследований позволяют прийти к заключению о том, что у детей и подростков с генотипом Arg192/Arg ограничивается развитие осложнений ожирения у мальчиков и предупреждается их возникновение у девочек. Оценивая возможные причины данного феномена, следует заметить, что появление в генотипе двух аллелей, кодирующих полипептидную цепь фермента с аргинином в 192 положении, способствует повышению активности параоксоназы. Принимая во внимание современные представления о роли этого фермента в липидном обмене, метаболизме липопротеинов крови и регуляции скорости свободнорадикальных процессов в них, становится понятной причина обнаруженного феномена. Вместе с тем, следует особо отметить, что данный генотип встречается значительно реже других. При других вариантах генотипа по полиморфизму rs662 PON-1 (генотипы Gln192/Gln и Gln192/Arg) в организме девочек формируются защитные механизмы, направленные на предупреждение осложнений при ожирении, а также их выраженности. У мальчиков с генотипом Gln192/Gln при ожирении выявляются более выраженные сдвиги со стороны показателей липидного обмена, формируются предпосылки для снижения активности PОN-1, имеют место проявления альтерации и увеличение массы жировой ткани, оцениваемой по величине SDS-ИМТ. Характерной особенностью мальчиков с ожирением, имеющих гетерозиготный генотип Gln192/Arg, является усиление процессов атерогенеза в организме.
Актуальность. Параганглиомы и феохромоцитомы (ПГ/ФХ) являются редкими нейроэндокринными опухолями, развивающимися из хромаффинных клеток мозгового вещества надпочечников, ганглиев симпатической или парасимпатической нервной системы (Redlich A, 2021). Показано, что в основе развития 70–80% случаев ПГ/ФХ лежат синдромы наследственной предрасположенности к опухолям, ассоциированные с мутациями генов SDHx, VHL, RET, NF1 (Crona J, 2017). Билатеральное поражение надпочечников встречается в 24–38% случаев ФХ у детей, предрасполагающими факторами являются синдром множественных эндокринных неоплазий 2 типа и синдром фон Хиппеля-Линдау (Kittah NE, 2020). При билатеральной ФХ на фоне синдрома фон Хиппеля-Линдау отдается предпочтение в выполнении органосохраняющих операций ввиду низкого злокачественного потенциала новообразований.
Цель. Изучить клинические и молекулярно-генетические особенности пациентов с билатеральной феохромоцитомой, получавших лечение на базе ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева.
Материалы и методы. За период 2012–2023 гг. 20 пациентов с ПГ/ФХ получали лечение (n=17) или консультативную помощь (n=3) в ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева, среди которых билатеральное поражение надпочечников отмечено у 4 (20%) пациентов. Диагноз во всех случаях был верифицирован гистологически. Всем пациентам проводилось молекулярно-генетическое исследование для поиска герминальных патогенных вариантов в генах, ответственных за развитие ФХ, ПГ в лаборатории молекулярной биологии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева. Использовался метод секвенирования нового поколения (NGS-панель «Синдромы предрасположенности к опухолевым заболеваниям»), по показаниям — другие методики. Под синхронными понимали опухоли, развившиеся в течение 6-месячного интервала.
Результаты. Медиана возраста 4 пациентов с билатеральным поражением надпочечников составила 9,5 года (разброс 4,5–14,6). Все пациенты были лицами мужского пола. В нашем наблюдении отмечалось синхронное развитие билатеральной ФХ и ПГ у 1 пациента. В 100% случаев (4/4) в дебюте заболевания отмечена артериальная гипертензия, в связи с чем пациентам проводилась предоперационная подготовка альфа-адреноблокаторами с целью достижения контроля артериального давления в течение 10–14 дней. Медиана дозы доксазозина составила 2 мг (разброс 2–4 мг) в сутки, один пациент получал многокомпонентную гипотензивную терапию, включая блокаторы кальциевых каналов, и бета1-адреноблокаторы. У последнего пациента диагностирована вторичная кардиомиопатия (дилатационный фенотип) со снижением сократительной способности миокарда, эксцентрической гипертрофии миокарда левого желудочка. По результатам биохимического анализа суточной мочи у всех пациентов отмечалось повышение норметанефринов более 4 норм. В ходе молекулярно-генетического анализа методом Multiplex ligation-dependent probe amplification (MLPA) у всех пациентов (4/4) выявлен патогенный герминальный вариант в гене VHL в 3 экзоне. У 2/4 (50%) пациентов отмечены доказанные случаи развития ПГ/ФХ в семье. Хирургическое лечение в объеме R0/R1 резекции проведено во всех случаях. Двум пациентам проведена операция по месту жительства. В одном случае выполнена двусторонняя адреналэктомия, в последующем у ребенка отмечено развитие локального рецидива, потребовавшего хирургического лечения в условиях НМИЦ ДГОИ. В другом у пациента с синхронными ФХ и ПГ проведена односторонняя адреналэктомия, в дальнейшем в условиях НМИЦ ДГОИ проводилось лапароскопическое удаление параганглиомы забрюшинного пространства и резекция контрлатерального надпочечника. Два пациента инициально оперированы в НМИЦ ДГОИ в объеме двухсторонней органосохраняющей операции (n=1) и адреналэктомии в сочетании резекцией надпочечника на противоположной стороне (n=1). Таким образом, органосохраняющая операция на одном/двух надпочечниках была проведена в 3/4 случаев. Заместительную терапию гидрокортизоном получает 1/4 пациент, подвергшийся билатеральной адреналэктомии. Морфологическая система оценки злокачественности по шкале GAPP использовалась у всех пациентов, оценивалась опухоль с наибольшим количеством баллов: в 3/4 случаях имели место умеренно-дифференцированные опухоли (3–6 баллов), в 1/4 — высокодифференцированные опухоли (0–2 балла). У 1/4 (25%) пациента отмечено развитие локального рецидива через 18,4 мес от момента постановки диагноза. Общая выживаемость в данной когорте составила 100% с медианой длительности наблюдения 8,1 мес (разброс 0,8–50,2).
Выводы. Билатеральные ФХ — очень редкие новообразования детского возраста, требующие обязательного медико-генетического консультирования для выявления синдромов предрасположенности к опухоли. Целесообразно мультидисциплинарное обсуждение тактики хирургического лечения с предпочтительным проведением органосохраняющих операций на надпочечнике с одной или двух сторон в центрах, специализирующихся на детской онкохирургии. Все пациенты с патогенными герминальными вариантами в генах, ассоциированных с ПГ/ФХ, требуют пожизненного динамического наблюдения.
Актуальность. Интенсификация терапии у пациентов с нейробластомой (НБ) группы промежуточного/высокого риска привела к улучшению выживаемости, но в тоже время в группе выживших отмечается высокая частота встречаемости отдаленных побочных эффектов терапии. Самыми серьезными побочными эффектами являются вторичные злокачественные опухоли (ВЗО) с частой встречаемости 1,2% (Mark A. Applebaum, 2015).
Цель. Оценить частоту и факторы развития ВЗО у выживших пациентов с НБ, получивших терапию в НМИЦ ДГОИ им. Дмитрия Рогачева.
Материалы и методы. В исследование включено 199 выживших пациентов с НБ группы высокого/промежуточного риска, которые получили специфическое лечение на базе НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России с января 2012 по декабрь 2019 гг. с медианой наблюдения 56 месяцев (разброс 16,4–124,3).
Результаты. В ходе проспективного исследования выявлено 4 случая (2%) ВЗО (одна из которых опухоль с неопределенным биологическим поведением): периваскулярная эпителиоидноклеточная опухоль (ПЕКома) поясничной мышцы справа (n=1), папилярная карцинома щитовидной железы (n=2), вторичный острый миелоидный лейкоз (ОМЛ) (n=1). Медиана возраста на момент постановки вторичных ЗНО — 105 месяцев (разброс 60–128). Медиана времени от момента завершения специфической терапии до ВЗО составила 9 месяцев (разброс 1–26 месяцев).
Вторичный ОМЛ установлен у мальчика через 1 месяц после завершения терапии по поводу НБ для группы промежуточного риска и терапии рецидива, включавшую 6 курсов по схеме TOTEM (топотекан/темозоломид), высокодозную химиотерапию (треосульфан/мелфалан) и ауто-ТГСК, лучевую терапию на область рецидива опухоли, локализованной в забрюшинном пространстве (СОД 21Гр), метрономную терапию по схеме CCV/CCVE (винбластин/целекоксиб/ циклофосфамид/этопозид). Пациенту проводилась специфическая терапия по поводу вторичного ОМЛ. В настоящее время пациент жив в ремиссии, длительность наблюдения 54 месяца.
ПЕКома развилась у пациента с первично-множественной НБ группы высокого риска через 26 месяцев от завершения терапии. Было выполнено радикальное хирургическое удаление. В настоящее время пациент жив с ПО, длительность наблюдения 10 месяцев.
Выявлено два папиллярных рака щитовидной железы (pT1bN0M0 и pT2N1bM0) у пациентов с рецидивами НБ группы высокого риска, диагностированные через 9 месяцев (у обоих) от завершения терапии. Однако только один пациент получил 131-I-МЙБГ терапию в первой линии, после которой через 12 месяцев был установлен первичный гипотиреоз. Обоим больным выполнено радикальное хирургическое вмешательство, в первом случае — тиреоидэктомия с микрохирургическим невролизом возвратных гортанных нервов и биопсией шейных лимфатических узлов VI-VII уровней, во втором — тиреоидэктомия, центральная (VI–VII) шейная лимфодиссекция, биопсия лимфатических узлов шеи с последующей двусторонней лимфодиссекцией. В настоящее время пациенты живы с длительностью наблюдения 2 и 10 месяцев соответственно.
Заключение. Вторичные злокачественные опухоли являются редким, но грозным осложнением терапии пациентов с НБ. Важное значение имеет тщательное динамическое наблюдение за больными с НБ, завершившими лечение с формированием алгоритма обследования на основе объема проведенной терапии. Также показано проведение генетических исследований, направленных на выявление герминальных мутаций, предрасполагающих к развитию вторичных ЗНО.
Актуальность. Параганглиомы и феохромоцитомы (ПГ/ФХ) являются редкими нейроэндокринными опухолями, развивающимися из хромаффинных клеток мозгового вещества надпочечников, ганглиев симпатической или парасимпатической нервной системы. Особенностью патофизиологии ПГ/ФХ является гиперпродукция катехоламинов, которая лежит в основе клинической картины и диагностики заболевания методом определения фракционированных метанефринов/норметанефринов в моче или в плазме крови. Показано, что в основе развития 70–80% случаев ПГ/ФХ лежат синдромы наследственной предрасположенности к опухолям, ассоциированные с мутациями генов SDHx, VHL, RET, NF1. Хирургическое лечение является золотым стандартом терапии ПГ/ФХ. ЦЕЛЬ. Изучить клинические и молекулярно-генетические особенности пациентов с ПГ/ФХ, получавших лечение или консультативную помощь на базе ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева.
Материалы и методы. В исследование включено 14 пациентов с ПГ/ФХ, получавших лечение (n= 11) или консультативную помощь (n=3) в ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева за период 2012–2021 гг. Диагноз во всех случаях был верифицирован гистологически. Всем пациентам проводилось молекулярно-генетическое исследование методом секвенирования нового поколения (NGS-панель «Синдромы предрасположенности к опухолевым заболеваниям») в лаборатории молекулярной биологии ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева. Под синхронными понимали опухоли, развившиеся в течение 6-месячного интервала.
Результаты. Медиана возраста пациентов составила 10,2 года (разброс 4,5–17,2). Из 14 пациентов у 10 (71,4%) диагностирована ПГ, в 4 (28,6%) случаях ФХ. У 7 (50%) пациентов в дебюте заболевания отмечена артериальная гипертензия. ПГ в 50% (5/10) случаев локализовалась в забрюшинном пространстве, в 30% (3/10) случаев отмечалось поражение шеи, в 20% (2/10) — мочевого пузыря.
Патогенный вариант в генах, ассоциированных с развитием ПГ/ФХ, был обнаружен у 12/14 (85,7%) пациентов: SDHB — 9/12 (75%), SDHD — 2/12 (16,7%), VHL — 1/12 (8,3%). В 1 случае выявлен герминальный вариант в гене KIF1B, у 1 пациента патогенные герминальные варианты не идентифицированы. У 3/12 (25%) пациентов отмечены доказанные случаи развития ПГ/ФХ в семье, у 2/12 (16,7%) пациентов отмечено носительство патогенных герминальных вариантов у родителей без развития ПГ/ФХ. В 3/5 случаях отмечалась мутация в гене SDHB, в 1/5 — в гене VHL, в 1/5 случае — в гене SDHD. На момент постановки диагноза у 2/14 (14%) пациентов отмечались синхронные опухоли (ПГ, n=1, ФХ, n=1): билатеральное поражение надпочечников ФХ при синдроме фон Хиппеля-Линдау (мутация в гене VHL) и синхронные параганглиомы шеи на фоне герминальной мутации в гене SDHD. Хирургическое лечение в объеме R0/R1 резекции проведено во всех случаях. Морфологическая система оценки злокачественности по шкале GAPP (Grading System for Adrenal Pheochromocytoma and Paraganglioma) использовалась у 10/14 пациентов: в 8/10 случаях имели место умеренно-дифференцированные опухоли (3–6 баллов), в 2/10 — высокодифференцированные опухоли (0–2 балла). У 5/14 (35,7%) пациентов отмечено развитие неблагоприятных событий: локальный/локорегиональный рецидив (n=3), метастатический рецидив (n=1), комбинированный рецидив (n=1). В 4/5 (80%) случаях новые события отмечались у пациентов с мутацией в гене SDHB, включая метастатический и комбинированный рецидив, в 1/5 (20%) случае с мутацией в гене VHL, в то время когда пациенты, не имеющие патогенных вариантов в генах, ассоциированных с развитием ПГ/ФХ, неблагоприятные события не развивали.
Медиана времени до события — 18,4 мес (разброс 3,7–29,9). С учетом агрессивного течения заболевания 2/14 пациента получали системную терапию темозоломидом, одному больному дополнительно проведена радиотаргетная терапия 131I-метайодбензилгуанидином (131I-МЙБГ) в связи с наличием МЙБГ-позитивных очагов в костях скелета. Двухлетняя общая выживаемость в данной когорте составила 100% с медианой длительности наблюдения 12,9 мес (разброс 0,5–93,4), двухлетняя бессобытийная выживаемость — 58±17% соответственно.
Заключение. ПГ/ФХ — редкие новообразования детского возраста, требующие обязательного медико-генетического консультирования для выявления синдромов предрасположенности к опухоли. Патогенные герминальные варианты в генах SDHx являются наиболее частыми молекулярно-генетическими событиями при ПГ/ФХ у детей и подростков. Радикальная операция является терапией выбора. Требуется длительное наблюдение за пациентами с учетом риска развития неблагоприятных событий, включая формирование метахронных опухолей.
Актуальность. Рак щитовидной железы (ЩЖ) занимает пятое место в мире по распространенности (Jemal, et al., 2010 г.). Рост заболеваемости почти полностью обусловлен наиболее распространенным гистологическим типом — папиллярным раком ЩЖ (EER Cancer Statistics Review, 2017 г.). Химерные гены слияния играют важную роль как в этиологии, так и в патогенезе рака и рассматриваются в качестве потенциальных диагностических и прогностических маркеров и возможных терапевтических мишеней. Наличие химерных генов — слияний (fusion): RET — ССDC6, RET — NCOA4, ETV6 — NTRK3 в биологических пробах является специфичным для карцином ЩЖ папиллярного типа (Nakazawa T, et al, 2005 г.), в связи с чем обнаружение данных альтераций является достоверным указанием на наличие папиллярного рака ЩЖ. Своевременная и точная диагностика позволит определить причину на начальном этапе проявления заболевания, дифференцировать доброкачественные и злокачественные узлы, лимфомы ЩЖ и метастазы в нее.
Материалы и методы. В качестве биоматериала использовались FFPE-блоки с дифференцированными формами рака ЩЖ. Из FFPE была выделена тотальная РНК, была амплифицирована кДНК с помощью гексамеров. Была проведена кПЦР. Реакционная смесь содержала кДНК, TaqMan-зонды, смесь 1X qPCRmix-HS (Евроген, Россия), прямой и обратный праймеры. TaqMan-зонды подбирались по свечению на участок хромосомной перестройки с участием гена RET (RET/PTC1: [VIC] CCAGCGTKACCATCGAGGATCCA (BHQ2); RET/PIC3: [VIC] AAAGCAGACCTTGGAGAACAGTCAGGAGG (BHQ2); ETV6-NTRK3: [VIC] GCCCATTGGGAGAATAGCAGATGTGC (BHQ2)). Были подобраны специфические праймеры на каждую перестройку RET/PTC1: прямой — 5’ TGCAGGAGGAGAACCG3’, обратный — 5’GAACCAAGTCTCCGAGGGA3’; RET/PIC3: прямой — 5’CCCCAGGACTGGTTACCC3’, обратный — 5’GAACCAAGTCTCCGAGGGA3’; ETV6-NTRK3: прямой — 5’CTGTCTCCCCGCCTGAAGA3’, обратный — 5’TTCTCGCTTCAGCACGATGT3’. кПЦР проводили в амплификаторе QuantStudio 5 (Thermo Scientific, США) по программе: 95 °C в течение 5 мин, 40 циклов при 95 °C в течение 10 с, 60 °C в течение 10 с, 72 °C в течение 10 с. Для внутреннего контроля прохождения ПЦР использовали прямой и обратный праймеры, TaqMan-пробу для измерения уровня экспрессии гена GAPDH (эндогенный контроль).
Результаты. Выделенная РНК из FFPE всех образцов имела индекс DV200 более 50%. Амплификация целевого гена наблюдалась в канале VIC/JOE. Результаты регистрировались как отрицательные, если не было сигмоидальной кривой и >35, и как положительные, если была сигмоидальная кривая с ˂ 35. Положительные образцы были повторно проверены секвенированием по Сэнгеру с прямого и обратного праймера, все химерные гены подтвердились. У проб с отрицательным контролем (mQ) не было обнаружено сигмоидальной кривой. Во всех образцах на 30–32 циклах поднимался GAPDH. Перестройка RET/PTC1 была обнаружена в трех образцах. Перестройка RET/PTC3 была обнаружена в трех образцах. Перестройка ETV6-NTRK3 была обнаружена в одном образце.
Заключение. Было подтверждено, что у пяти из шести пациентов с перестройками была диагностирована папиллярная карцинома, и у одного фолликулярная аденома. Полученные результаты показывают, что разработанная тест-система с достаточно высокой точностью (100%) может выявлять экспрессию химерных генов — слияний (fusion): RET- ССDС6, RET- NCOA4, ETV6-NTRK3.
Актуальность. В последние годы прогрессивно увеличивается количество новых случаев опухолей щитовидной железы (ЩЖ), среди которых на долю доброкачественных неоплазий приходится более 80%. Фолликулярные аденомы ЩЖ (ФА ЩЖ) в общей структуре узловых образований ЩЖ составляют 10–15%. Этиология и патогенез развития опухолей ЩЖ недостаточно изучены, и остается еще много нерешенных вопросов. В последние годы большое внимание отводят особенностям питания и роли дефицита эссенциальных микроэлементов (МЭ) в развитии неопластических процессов. Имеются убедительные данные о роли МЭ и дисэлементозов в формировании узлового зоба ЩЖ, однако значение нарушений обмена микроэлементов в опухолевой прогрессии ЩЖ не изучено. Это послужило поводом для проведения настоящего исследования.
Материалы и методы. В исследование были включены 107 женщин, средний возраст 53 года (42; 60) с диагнозом ФА ЩЖ. Группу контроля составили 46 женщин, средний возраст 53 года (42; 57), не имеющие тяжелой соматической и эндокринной патологии. У пациентов оценивали антропометрические показатели (рост, вес, индекс Кетле), показатели крови: тиреотропный гормон (ТТГ), свободный тироксин (св.Т4) методом иммуноферментного анализа (ИФА), уровни селена и цинка в волосах методом атомно-абсорбционной спектрофотометрии на спектрофотометре В-1100 с диапазоном 315–1050 нм, срезы волос проводили в затылочной области из 2–3 участков длиной не ˂ 3 см на уровне 3–5 см выше корней волос, оценка ЩЖ методом УЗИ. Референсные значения ИМТ 18,5–25 кг/м2 , ТТГ — 0,4–4,0 мкЕд/мл, св.Т4 — 9–22 пмоль/л, в волосах селен — 0,15–1,8 мкг/г, цинк — 180–230 мкг/г, объем ЩЖ 9–18 см3 . Полученные данные проанализированы в Statistica 6.1. Статистически значимыми считали различия при p ˂ 0,05.
Результаты. Пациенты обеих групп были сопоставимы по возрасту, р=0,06. Клинически и лабораторно у всех обследованных подтвержден эутиреоз. Не было отличий в сравниваемых группах и по ИМТ. Так, у большинства пациентов обеих групп зарегистрирована избыточная масса тела или ожирение: в группе ФА ЩЖ избыток массы тела имели 30,8%, ожирение — 38,4% пациентов, в группе контроля — 30,4% (р=0,97) и 41,3% (р=0,38) соответственно. Средний показатель ИМТ в сравниваемых группах статистически не отличался: в группе с ФА ЩЖ — 28 кг/м2 (23,6; 42), в группе контроля — 28,45 кг/м2 (24,7; 32,9), р=0,22.
Однако при оценке обеспеченности МЭ — селеном и цинком, выявлены значимые различия. Установлено, что более 2/3 пациентов в группе ФА ЩЖ-70,1% имели низкий уровень селена, тогда как в группе контроля селен был снижен только у 4,6% пациентов (р=0,001). При этом средний уровень селена в волосах в группе ФА ЩЖ был ниже референсных значений — 0,13 (0,09; 0,15) мкг/г, и значимо более низким по сравнению с группой контроля — 0,17 (0,15; 0,28) мкг/г (р=0,000). Также более половины пациентов с ФА ЩЖ — 66,4% имели низкий уровень цинка, тогда как в группе контроля показатель был снижен только у 17,4% пациентов (р=0,000). Средний уровень цинка в волосах у женщин с ФА ЩЖ был ниже референсных значений — 175 (169; 180) мкг/г, в контрольной группе соответствовал референсным значениям — 184,5 (181; 189) мкг/г (р=0,000).
Заключение. Большая часть пациентов с ФА ЩЖ имели недостаточную обеспеченность эссенциальными МЭ — селеном и цинком. Более 2/3 пациентов в группе ФА ЩЖ имели дефицит селена (70,1%), а более половины пациентов — дефицит цинка (66,4%). Данные показатели в группе контроля были статистически выше (р=0,000), а средние значения не отличались от референсных. Дефицит селена установлен только у 4,6% (р=0,001), а цинка — у 17,4% (р=0,000) пациентов группы контроля. Проведенное исследование свидетельствует, что низкая обеспеченность селеном и цинком является одним из вероятных факторов формирования ФА ЩЖ, требует контроля и коррекции при обнаружении дефицита.
Актуальность. Развитие гипопитуитаризма у пациентов с менингиомой встречается очень редко.
Методы. В декабре 2022 г. к эндокринологу обратилась пациентка с результатами МРТ головного мозга без контраста, 0,5 Тесла. Предъявляла жалобы: снижение веса на 4 кг, уменьшение в размерах левого глаза, периодическое снижение зрения на этом глазу, дискомфорт в области левого сосцевидного отростка. В 2013 г. у пациентки удалены яичники в связи с острым перитонитом, с этого времени принимает Три-Регол, менструальный цикл регулярный. По МРТ в проекции гипофиза — объемное образование с супра-инфра-латероселлярным ростом с распространением влево, прорастающее в основную пазуху, деформирующее хиазму, охватывающее сифоны внутренних сонных артерий, деформирующее медиальные отделы левой височной кости, скат мозга размерами 3,2–3,9–3,4 см. Гормональное исследование проведено методом ИХЛА с использованием реактивов Mindray (Китай). Результаты на 08.01.23: ФСГ — 0,26, ЛГ — 0,08, ТТГ — 0,7 (референс 0,35–4,94), Т4св. — 9,52 (9,0–19,5), пролактин — 2262 (108–557), мономерный пролактин — 1928 (85% от общего), кортизол — 7,3 мкг/мл (3,7–19,4), ИПФР — 182,3 нг/мл (86,5–222,0) оценивался методом ИФА, реfrnbds DRG Instruments GmbH (США), глюкоза — 5,3, калий — 4,22, натрий — 143,9 ммоль/л, осмолярность — 301 мосмоль/л. Периметрия, острота зрения, глазное дно без патологии.
Невролог выявил нейропатию отводящего нерва слева. Диагноз: макроаденома гипофиза с инфра-супра-латероселлярным ростом, вторичный гипотиреоз, гиперпролактинемия, пролактинома? Назначения: терапия левотироксином 75 мкг, каберголином 0,25 мг 2 раза в неделю. После осмотра главного нейрохирурга области рекомендовано хирургическое лечение в НМИЦ нейрохирургии им. Н.Н. Бурденко. Через 2 месяца на фоне лечения Т4св. — 13,71 — эутиреоз, пролактин — 12,6 мМЕ/л — снижен. При повторном МРТ (впервые с контрастом, 1,5 Тесла). Заключение: менингиома средней черепной ямки, размер: 4,2–4,4–4,0 см, маловероятно: макроаденома гипофиза. В лечении отменен каберголин. В динамике: Т4св. — 13,7 пмоль/л (6,4–18,2), ИПФР-1=-113,9 нг/мл, ПРЛ — 206,82 мМЕ/Л (108–557), кортизол — 232,8 нмоль/л (176,6–629,0). В июле 2023 г. выполнена компьютерно-томографическая перфузия головного мозга (НМИЦ им. Н.Н. Бурденко). Заключение: менингиома. Диагноз после обследования в НМИЦ им. Н.Н. Бурденко: менингиома основания черепа (поражены ХСО, скат, левый кавернозный синус, клиновидная кость). Осложнения: вторичный гипотиреоз, компенсация, гипогонадизм, компенсация Три-Реголом, гипопсия височной половины слева, недостаточность 3-го нерва слева. Рекомендована частичная резекция опухоли с последующей плановой лучевой терапией.
Результаты. Данный клинический случай интересен развитием частичной гипофизарной недостаточности у пациентки с малосимптомным течением менингиомы больших размеров.
Заключение. При обнаружении крупных опухолей средней черепной ямки требуется исключение гипофизарной недостаточности.
Актуальность. Медуллярный рак — редкое заболевание в практике эндокринолога.
Материалы. В апреле 2023 г. к эндокринологу обратился мужчина 43 лет с жалобами на опухоль на шее в течение года. Правая доля щитовидной железы представляла собой образование диаметром до 4,5 см, очень плотное, неоднородное, не смещаемое.
Лабораторное обследование проведено методом ИФА с использованием реактивов Biomerica inc. (США). Кальцитонин — 1059 пг/мл, ТТГ — 1,74. При повторном исследовании с разведением кальцитонин — 10 195 пг/мл. Выставлен диагноз: «Медуллярный рак», и пациент направлен к онкологу. Перед операцией в Томском НМИЦ онкологии кальцитонин — 5 674 пг/мл. По УЗИ щитовидной железы: опухоль занимает всю правую долю: 3,9–3,2–5,0 см, гипоэхогенная, с четким неровным контуром, высокой васкуляризацией. По МСКТ: в правой доле щитовидной железы опухоль 3,7–3,6–4,9 см без признаков распространения за пределы органа, верхне-яремные лимфоузлы — 8–12 мм, подчелюстные — 16–12 мм, подбородочные — до 8 мм справа. Слева — верхне-яремные лимфоузлы 13–8,8 мм, подчелюстные — до 7 мм. МРТ головного мозга с контрастом, МСКТ органов грудной клетки метастазов не выявило. Сцинтиграфия костей с 99 мТс пирфотех — метастазов опухоли не обнаружила. 30.05.2023 г. — тиреоидэктомия. Удалена опухоль 3,5–4,5 см с плотной фиброзной капсулой, прорастания в окружающую ткань и капсулу щитовидной железы не было. По результату иммуногистохимического анализа опухоль вырабатывала кальцитонин, продукции тиреоглобулина не было. Диагноз после операции: «Медуллярный рак Т3N0M0». В настоящее время наблюдается у эндокринолога, получает заместительную терапию левотироксином.
Результаты. Через 3 месяца уровень кальцитонина методом ИФА — 11 пг/мл. Проведено исследование мутации гена RET. Мутации не выявлено.
Заключение. Тиреоидэктомия проведена через месяц после первичной диагностики медуллярного рака. Случай интересен отсутствием регионарных и отдаленных метастазов при больших размерах первичной опухоли, что, вероятно, связано с наличием плотной фиброзной капсулы у опухоли. Кроме того, уже через 3 месяца после тиреоидэктомии уровень кальцитонина нормализовался, что позволяет надеяться на благоприятный прогноз.
Результаты. Несмотря на возможность злокачественного роста параганглиом шеи (ПГ) с достаточным метастатическим потенциалом (ПГ), механизмы их патогенеза остаются до сих пор недостаточно изученными. В частности, практически незатронутыми остаются вопросы биологии тучных клеток, ассоциированных с ПГ (ТК), несмотря на их ключевую роль в формировании опухолевого микроокружения. В настоящей работе с помощью трансмиссионной электронной микроскопии проведен анализ ТК в ПГ, в том числе наноструктурных эквивалентов эффекторного воздействия на опухолевые, иммунные и стромальные клетки опухолевого микроокружения ПГ. По результатам гистохимического анализа и иммуногистохимического окрашивания выявлено, что ПГ практически у всех пациентов обладают многочисленной опухоль-ассоциированной популяцией ТК. При этом ТК характеризуются высокой экспрессией специфических протеаз, вариабельным ультраструктурным фенотипом гранул и электронно-микроскопическими характеристиками таргетной секреторной деятельности. Впервые выявлены наноструктурные особенности механизмов воздействия ТК на опухолевые клетки параганглиом, иммунокомпетентные клетки, фибробласты, а также на ремоделирование волокнистого и аморфного компонентов внеклеточного матрикса. Обнаруженные ультраструктурные особенности воздействия секретома ТК на микроокружение параганглиом подтверждают их важное патогенетическое значение в прогрессии опухоли и могут быть использованы как для идентификации про- и антитуморогенных эффектов и новых диагностических критериев, так и разработке протоколов персонализированной терапии.
Актуальность. Улучшение качества диагностики опухолей гепатопанкреатобилиарной зоны обуславливает рост количества вмешательств на поджелудочной железе, а появление в арсенале хирургов современных органосберегающих методик — расширение показаний к их применению. Именно эти факторы на сегодняшний день определяют изменение парадигмы хирургического лечения пациентов с нейроэндокринными опухолями (НЭО) поджелудочной железы.
Материалы и методы. За период с ноября 2013 по июнь 2023 гг. на лечении в Клинике находилось 127 пациентов с НЭО поджелудочной железы. Возраст больных составил 58,2±10,6 лет (от 19 до 79 лет), соотношение мужчин и женщин 1:3. Применялся дифференцированный алгоритм, основанный на прецизионном дооперационном обследовании, включая весь арсенал лучевых методов диагностики. При краевом расположении солидной опухоли такой пациент рассматривался в качестве претендента на выполнение органосберегающего вмешательства — энуклеации. При локализации опухоли в толще паренхимы железы либо при интимном прилежании к главному панкреатическому протоку операцией выбора служили резекционные методики: панкреатодуоденальная резекция (как правило, в пилосохраняющем варианте), центральная или дистальная (в модификации Kimura) резекция. При множественном поражении поджелудочной железы выполнялась тотальная дуоденпанкреатэктомия в модификации Боткинской больницы с сохранением привратника, селезенки и селезеночных сосудов. При наличии же отдаленных метастазов применялись все варианты локорегионарного воздействия, включая трансартериальную химиоэмболизацию, аблационные методики, их сочетание, а также различные варианты лекарственного лечения. Хирургические вмешательства выполнялись традиционным, лапароскопическим, а также роботическим способом (с 2013 года применяется роботическая система daVinci Si, а с 2022 года — daVinci Хi). За период с ноября 2013 по июнь 2023 года на лечении находилось 127 пациентов с нейроэндокринными опухолями поджелудочной железы. Возраст больных составил 58,2±10,6 лет (от 19 до 79 лет). Выполнено ПДР — 4 (1 роботическая), центральных резекций — 6 (2 роботических), дистальных резекций — 71 (49 лапароскопических, 15 роботических, 5 лапаротомных), тотальных дуоденпанкреатэктомий — 4, энуклеаций — 12 (9 роботических, 2 лапароскопических), ТАХЭ — 21 (из них 4 — головки поджелудочной железы), аблаций (РЧ и СВЧ) — 8.
Результаты. Частота применения минимально инвазивных хирургических методик составила 86,5%, при этом при применении резекционных способов лечения центральных и левых отделов поджелудочной железы количество спленсохранных операций составило 77/81 (95,1%). Послеоперационный койко-день составил 9,1 (1–62). Количество общехирургических осложнений по классификации Clavien-Dindo составило 29 (23%), при этом отмечено одно осложнение категории V (0,79%). В структуре специфических осложнений по ISGPS после резекционных вмешательств отмечены панкреатические свищи классов «В» (17 случаев — 17,5%) и «С» (2 случая — 2,1%) и одно геморрагическое осложнение класса «С» у пациента после лапаротомного вмешательства в объеме центральной резекции поджелудочной железы.
Выводы. Персонифицированный подход к лечению пациентов с нейроэндокринными опухолями поджелудочной железы, а также применение современных лапароскопических и роботических технологий позволяют расширить возможности органсберегающей хирургии и добиться улучшения как непосредственных хирургических, так и отдаленных онкологических результатов.
Актуальность. Сердечная недостаточность (СН) с промежуточной фракцией выброса (ФВ) впервые прозвучала в 2013 году. Позже, в 2016 г. Европейское общество кардиологов официально определило СН с промежуточной ФВ как ФВ от 40 до 49%. С тех пор прошло не так много времени, поэтому к настоящему времени информации по данному синдрому недостаточно.
Цель. Изучение особенности взаимосвязи фракций выброса у пациентов с СН при ИБС с различной степенью ожирения.
Материалы и методы. В исследование были включены 289 пациентов, прошедших лечение в 2022 году в Павлодарском областном кардиологическом центре, из них 203 мужчин, 92 женщины в возрасте от 35 до 83 лет. Пациенты были разделены на группы по гендерному признаку и степени ожирения, а также ранжированы по подгруппам в соответствии с градацией ФВ (сохраненная, промежуточная, низкая). Сердечную деятельность изучали ультразвуковым методом с использование аппарата «Vivid 9» (General Electric, USA). Анализу подвергли отдельные показатели общеклинического и специальных методов обследования (ЭхоКГ).
Результаты и обсуждение. В таблицах №1 и 2 приведены общие данные, демонстрирующие статистику выявленных отклонений показателей ФВ во взаимосвязи со степенью ожирения обследованных пациентов. Из данных, приведенных в таблицах, видны следующие особенности, во-первых, мужчин было госпитализировано в два раза больше (198 пациентов), чем женщин (91) — это можно расценивать как показатель заболеваемости с гендерных позиций, т.е. у мужчин сердечно-сосудистая патология, требующая оказания специализированной кардиологической помощи, встречается в два раза чаще, чем у женщин. Во-вторых, обращает на себя внимание отсутствие у женщин СН с низкой фракцией выброса, т.е. СН, можно предполагать, протекает клинически более благоприятно в противоположность мужчинам, так как у них из общего числа 8% пациентов страдают более выраженной формой сердечной недостаточности. Об этом свидетельствует и тот факт, что у женщин больший процент случаев как с сохраненной, так и с промежуточной ФВ. Кроме этого, получены данные, свидетельствующие о том, что хронической сердечной недостаточностью женщины страдают в меньшей степени (сохраненная ФВ в 73 против 68% у мужчин). Учитывая тот факт, что в исследовании женщин было в два раза меньше по количеству, то можно априори прийти к умозаключению о том, что если экстраполировать полученные данные к единообразию по количеству и допуская выявленную тенденцию как статистическую закономерность, то можно предположить, что количество пациентов с промежуточной ФВ, как более благоприятный вариант, превысит таковых у мужчин.
Актуальность. Рак легких (РЛ) является основной причиной смертности от онкопатологии во всем мире. Около 80% РЛ классифицируется как немелкоклеточный РЛ (НМРЛ). Учитывая высокую заболеваемость метастатическим НМРЛ и неэффективность используемых методов его терапии, идет активный научный поиск новых подходов к лечению. Новым обнадеживающим методом терапии является применение ингибиторов контрольных точек иммунитета или check-point ингибиторов. Контрольные точки или check-point белки представлены на иммунных клетках, а их стимуляция подавляет иммунитет, в том числе и противоопухолевый. Метаболическое микроокружение опухоли характеризуется дефицитом триптофана и повышением содержания иммуносупрессивных катаболитов данной аминокислоты. Целью нашей работы явилось изучение содержания различных метаболитов триптофанового обмена в сыворотке крови и кале здоровых доноров и у пациентов с РЛ, а также оценка изменения содержания триптофановых метаболитов в кале до и после проведения иммунотерапии ингибиторами PD-1/PD-L1.
Материалы и методы. В группу исследования вошли 100 здоровых и 100 больных НМРЛ, 20 пациентам проводилась иммунотерапия ингибиторами PD-1/PD-L1. Количественный анализ метаболитов триптофана в сыворотке крови и кале проводили методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим определением. РЕЗУЛЬТАТЫ. В кале больных РЛ повышено содержание индола и индол-3-ацетата. В плазме крови у пациентов с РЛ происходит статистически значимое снижение содержания триптофана, индол-3-ацетата, индол-3-пропионата и индол-3-лактата, серотонина, ксантуреновой кислоты и триптамина. При этом уровень хинолиновой кислоты и 5-гидроксииндолацетата у больных с РЛ в плазме крови повышены. После проведения иммунотерапии РЛ с использованием ингибиторов PD-1/PD-L1 содержание триптофана в кале значимо увеличивалась. В плазме крови на фоне проведения иммунотерапии ингибиторами PD-1/PD-L1 наблюдалось статистически значимое повышение хинолиновой кислоты и снижение серотонина.
Заключение. Нами установлено, что у больных РЛ происходит изменение метаболизма триптофана по всем трем основным путям катаболизма. Ожидаемо получено снижение триптофана в сыворотке крови у больных РЛ, при этом в кале данной группы больных содержание триптофана не изменяется, что подтверждает гипотезу о том, что рак — это «ловушка» триптофана и именно повышенное потребление триптофана из плазмы крови обуславливает его низкую концентрацию в ней. При РЛ метаболическая активность микробиоты изменяется. Например, отмечается повышение продукции индола и индол-3-ацетата в кишечнике, но при этом концентрация индол-3-ацетата в сыворотке крови у больных РЛ снижена, а уровень хинолиновой кислоты повышен, что может свидетельствовать об активном превращении индол-3-ацетата в хинолиновую кислоту у данной группы наблюдения. Проведение иммунотерапии PD-1/PD-L1 ингибиторами повышает продукцию триптофана микробиотой кишечника. При этом в сыворотке крови увеличивается уровень хинолиновой кислоты и снижается концентрация серотонина.
Актуальность. С каждым годом распространенность аутоиммунных заболеваний в мире неуклонно растет. Этиология и патогенез аутоиммунных заболеваний крайне сложные и во многом остаются неясными. Тем не менее все больше данных исследований последних лет указывает на критическую роль микроорганизмов в формировании нормального иммунного ответа и аутоиммунных реакций в организме хозяина. При этом одна из ведущих ролей отводится кишечной микробиоте, представленной триллионами микробов, образующих широкий спектр сигнальных и иммуннорегуляторных метаболитов. Формируя сложную взаимозависимую систему «хозяин-микробиота», симбиотические бактерии во многом определяют развитие и функционирование иммунных клеток человека.
Материалы и методы. Проведен анализ литературных данных за последние 5 лет в базе PubMed с использованием реферативной программы Mendeley – Reference Management Software. РЕЗУЛЬТАТЫ. У людей с различными аутоиммунными заболеваниями прослеживается тенденция к снижению биомассы и таксономического разнообразия микроорганизмов кишечника, метаболиты которых обладают иммуномодулирующими свойствами как, например, метаболиты триптофана. Все метаболиты триптофана являются сигнальными молекулами. Большинство из них оказывают свои эффекты AhR-зависимым (AhR — арилгидрокарбоновые рецепторы). AhR в большом количестве представлены в энтероцитах и в иммунных клетках. Установлено, что эффекты, опосредованные активацией AhR, вносят значительный вклад в поддержание целостности кишечного барьера, тем самым способствуя развитию иммунотолерантности. В качестве лигандов AhR выступают как эндогенные (кинуренин, кинуреновая и ксантуреновая кислоты и др.), так и микробные метаболиты триптофана (индол и его производные, а также триптамин). После активации AhR с лигандом транслоцируется в ядро и активирует экспрессию генов, ответственных за синтез интерлейкинов (ИЛ) — ИЛ-6 и ИЛ-22, а также важнейших ферментов кинуренинового пути — индоламин-2,3-диоксигеназы и триптофан-2,3-диоксигеназы, косвенно регулируя отношения между комменсальной микробиотой и хозяином. Никотинамидадениндинуклеотид (НАД+), который образуется из триптофана, является модулятором иммуно-метаболических взаимосвязей. НАД+ участвует в модификации белков и сигнальных молекул, в том числе выступая в качестве кофермента CD38, который гиперэкспрессируется при системных аутоиммунных заболеваниях в Т-лимфоцитах и натуральных киллерных клетках. Через белок-фермент CD38 осуществляется регуляция внутриклеточной концентрации кальция и иммунных клеток.
Заключение. Все метаболиты триптофанового обмена являются сигнальными молекулами и вовлечены как в регуляцию quorum sensing (QS) в микробиотической экосистеме кишечника, так и в регуляцию метаболизма и работы иммунной системы организма человека. Множество работ демонстрируют, что именно нарушение метаболического звена кинуренинового обмена триптофана является одним из ключевых механизмов аутоиммунных провокаций.
Актуальность. Существуют представления о различных причинах ожирения. Особое место среди них занимают генетические факторы, связанные, в том числе, с генетическим полиморфизмом ферментов, участвующих в липидном обмене. К таковым относится триацилглицероллипаза. Этот энзим представляет собой гликопротеин и синтезируется преимущественно в печени. Здесь он участвует в гидролизе триацилглицеролов липопротеинов крови, обеспечивая тем самым их катаболизм. Выявлены четыре распространенные варианта его однонуклеотидного полиморфизма, среди которых особое место занимает -250G/A (rs2070895). Несмотря на значительный интерес к изучению роли полиморфизма гена печеночной триацилглицероллипазы (LIPC) в развитии сердечно-сосудистых заболеваний и сахарного диабета 2 типа, до настоящего времени все еще отсутствуют ясные представления об его роли в развитии ожирения в детском и подростковом возрасте. Учитывая это, целью работы стало изучение взаимосвязи полиморфизма гена LIPC (rs2070895) с характером сдвигов в содержании адипокинов, миокинов и показателей липидного обмена в крови у детей и подростков разного пола с ожирением.
Материалы и методы. У 100 здоровых детей и подростков разного пола и 100 их сверстников с ожирением было проведено исследование по оценке snp гена LIPC по rs2070895. В сыворотке крови обследуемых определялись показатели липидного обмена, активности аланинаминотрансферазы и аспартатаминотрансферазы, а также уровень лептина, адипонектина, резистина, апелина, ирисина, адипсина, миостатина, FGF21, остеокрина, онкостатина М и аспросина.
Результаты. Установлено, что ожирение у мальчиков сопровождается гиперлептинемией, повышением уровня ТТГ, возникновением инсулинорезистентности и нарушений со стороны липидного обмена крови. У носителей гетерозиготного аллеля -250G/А при ожирении уменьшаются дислипидемия и атерогенез, но усиливается альтерация внутренних органов. У девочек с разными генотипами LIPC по rs2070895 при ожирении происходит повышение уровня лептина и апелина, а также ирисина в крови. У девочек носителей гомозиготного аллеля -250G/G, в дополнение к тому уменьшается содержание резистина и аспросина в крови, что не характерно для девочек с гетерозиготным аллелем -250G/А. У девочек с гетерозиготным аллелем при ожирении увеличивается уровень адипсина, FGF-21, онкостатина М и остеокрина, что не характерно для девочек с ожирением, носителей гомозиготного аллеля. На фоне изменений в содержании адипокинов и миокинов у девочек, гомозиготных по LIPC, при ожирении возникает дислипидемия, которая не характерна для девочек, носителей гетерозиготного аллеля -250G/А.
Заключение. У мальчиков и девочек носителей гетерозиготного аллеля -250G/А ограничивается вероятность возникновения дислипидемии. При этом у мальчиков, гетерозиготных по LIPC, не выявляются изменения в величине коэффициента атерогенности, а также гиперферментемии аминотрансфераз, указывающие на усиление атерогенеза и альтерацию тканей. Все это может быть обусловлено особенностями влияния соответствующих полиморфных форм печеночной триацилглицероллипазы на катаболизм липопротеинов крови и, соответственно, на ее липопротеиновый спектр. Вместе с тем ограничение сдвигов со стороны показателей липидного обмена в крови у мальчиков с ожирением, гетерозиготных по LIPC, сопровождается формированием у них тенденции к усилению инсулинорезистентности, что характерно для носителей данного генотипа при полиморфизме LIPC по rs2070895.
Актуальность. Эндокринопатии являются одними из наиболее распространенных аутоиммунных нежелательных явлений (АИНЯ), вызывающих тяжелые токсические осложнения на фоне применения терапии ингибиторов контрольных точек (ИИКТ).
Материалы и методы. Пациенту с жалобами на гиперпигментацию образования кожи спины в августе 2022 г. проведена эксцизионная биопсия, верифицирована пигментная эпителиоидноклеточная меланома с ростом опухоли по краю резекции. В декабре 2022 г. по МСКТ обнаружены метастазы в правых подмышечных и надключичных лимфоузлах, правом легком, в правой лопатке и в правой паховой области — mts меланомы кожи спины T4aN3M1b (R1), в связи с чем инициирована терапия пембролизумабом (человеческое моноклональное антитело IgG4 каппа, селективно блокирующее PD-1). На фоне лечения развился эпизод иммуноопосредованного артрита, назначался эторикоксиб с улучшением. В августе 2023 г. с проявлениями астенического синдрома, диспепсии (тошнота, рвота), повышением глюкозы венозной крови до 14–16 ммоль/л эндокринологом по месту жительства диагностирован сахарный диабет 2 типа, рекомендован прием метформина и глимепирида. В связи с отсутствием улучшения общего самочувствия пациент госпитализирован по «03» с диабетическим кетоацидозом в реанимационное отделение, где инициирована инсулинотерапия (инсулин гларгин 14 ЕД на ночь, инсулин короткого действия по 3–4 ЕД перед основными приемами пищи) с последующей стабилизацией состояния, но астения и гипотензия персистировали. В дальнейшем на основании низких значений АКТГ и кортизола крови, а также кортизола суточной мочи выявлена вторичная надпочечниковая недостаточность, по поводу которой назначался гидрокортизон. Из-за отсутствия компенсации надпочечниковой недостаточности препарат заменен на преднизолон в дозе 7,5 мг ->5 мг/сут. Позднее по причине выраженной гипотонии (АД 80/40 мм рт. ст.) к терапии добавлен флудрокортизон. После коррекции гормональных нарушений пациентом перенесено несколько хирургических вмешательств для лечения аневризм обеих общих подвздошных артерий, выявленных при контрольном МСКТ в декабре 2022 г., а именно ангиографии, подтвердившей многососудистое поражение коронарных артерий. В этой связи планируемое стентирование заменено на проведение аутовенозного аортокоронарного шунтирования задней межжелудочковой ветви правой коронарной артерии и задней боковой ветви артерии левой внутригрудной аорты в условиях искусственного кровообращения. В ноябре 2023 г. в ходе госпитализации в эндокринологический стационар ввиду низкого уровня С-пептида (0,0035<нг/мл) исследованы антитела к GAD (0,2 Ед/мл), к инсулину (2,68 Ед/мл); к тирозинфосфатазе (><1 Ед/мл), а также оптимизирована инсулинотерапия, стабилизированы показатели гликемии в пределах индивидуальных целевых значений. По данным гормонального анализа: инсулин — 1,42 мЕд/мл (2,6–24,9), АКТГ — 2,77 пг/мл (7,2–63,3), кортизол — 41,42 нмоль/л (171–536). На МРТ головного мозга визуализированы неоднородность аденогипофиза и формирующееся «пустое» турецкое седло. РЕЗУЛЬТАТЫ. В связи с улучшением общего самочувствия, медикаментозной компенсацией надпочечниковой недостаточности, нормализацией АД, стабилизацией показателей гликемии, пациент в настоящее время готовится к следующему этапу хирургического лечения — бифуркационое протезирование брюшной аорты. ЗАКЛЮЧЕНИЕ. Учитывая этиологические особенности возникновения АИНЯ на фоне применения ИИКТ, необходим мультидисциплинарный подход для комплексного и эффективного ведения пациентов, минимизации осложнений и полной реализации терапевтического потенциала этого метода лечения.> ˂ нг/мл) исследованы антитела к GAD (0,2 Ед/мл), к инсулину (2,68 Ед/мл); к тирозинфосфатазе (<1 Ед/мл)>˂ 1 Ед/мл), а также оптимизирована инсулинотерапия, стабилизированы показатели гликемии в пределах индивидуальных целевых значений. По данным гормонального анализа: инсулин — 1,42 мЕд/мл (2,6–24,9), АКТГ — 2,77 пг/мл (7,2–63,3), кортизол — 41,42 нмоль/л (171–536). На МРТ головного мозга визуализированы неоднородность аденогипофиза и формирующееся «пустое» турецкое седло.
Результаты. В связи с улучшением общего самочувствия, медикаментозной компенсацией надпочечниковой недостаточности, нормализацией АД, стабилизацией показателей гликемии, пациент в настоящее время готовится к следующему этапу хирургического лечения — бифуркационое протезирование брюшной аорты.
Заключение. Учитывая этиологические особенности возникновения АИНЯ на фоне применения ИИКТ, необходим мультидисциплинарный подход для комплексного и эффективного ведения пациентов, минимизации осложнений и полной реализации терапевтического потенциала этого метода лечения.
Актуальность. Согласно статистическим данным, в этиологической структуре АКТГ-эктопического синдрома феохромоцитома занимает одно из последних мест по частоте встречаемости (от 2,8 до 5,6%), что приводит к значительным сложностям диагностики данного заболевания.
Материалы и методы. У пациентки с клиническими проявлениями гиперкортицизма проведено лабораторное исследование в октябре 2022 г.: кортизол вечерней слюны — 220,6 нмоль/л, кортизол сыворотки крови вечером — 1548 нмоль/л, кортизол суточной мочи — 12332,25 нмоль/сут; АКТГ вечер — 204,1 пг/мл, утро — 313,4 пг/мл, метанефрин — 1122,9 мкг/сут, норметанефрин — 1039,11 мкг/сут. По МРТ головного мозга с контрастированием выявлена микроаденома (3х3,5 мм) в задней части аденогипофиза. Осуществлен поиск источника эктопии. На МСКТ легких и средостения объемные поражения не визуализированы. По МСКТ брюшной полости и забрюшинного пространства: образование левого надпочечника размерами 37х30х46 мм, злокачественного фенотипа плотностью 42/49/69/60 HU (активная/артериальная/венозная/отсроченная фазы), расцененное как очаг эктопической секреции АКТГ. В ходе двустороннего селективного забора из нижних каменистых синусов от 24.10.2022 г. отмечалось отсутствие градиента секреции АКТГ (максимальный справа — 1,15; слева — 1,10). На ОФЭКТ-КТ брюшной полости в левом надпочечнике определялось образование мягкотканной плотности размерами 39х30х49 мм, накапливающее тектротид, что подтвердило умеренно-повышенную экспрессию соматостатиновых рецепторов. Таким образом, полученные данные свидетельствовали в пользу внегипофизарного генеза АКТГ-зависимого гиперкортицизма. С учетом скорости прогрессирования заболевания однократно введен аналог соматостатина (ланреотид аутожель 120 мг п/к) — без существенной динамики снижения секреции АКТГ (с 313 до 243 пг/мл). Также назначен кетоконазол 600 мг/сут. — без эффекта на уровень кортизола суточной мочи (>35000 нмоль/сут). Проводилась терапия осложнений гиперкортицизма: в связи с выявленной гипокалиемией (до 1,9 ммоль/л) к терапии был добавлен спиронолактон 300 мг/сут. Ввиду впервые диагностированного СД вследствие гиперкортицизма инициирована инсулинотерапия по схеме: ИДД — гларгин 300 ЕД/мл 10 ЕД п/к в 22:00, ИУКД — аспарт по 4–8 ЕД п/к. В ноябре 2022 г. проведена левосторонняя адреналэктомия с предварительной подготовкой α-адреноблокатором доксазозином с эскалацией дозы до 4 мг/сут. Морфологическое исследование выявило феохромоцитому, по иммуногистохимии верифицирована интенсивная экспрессия хромогранина А и АКТГ клетками феохромоцитомы.
Результаты. В послеоперационном периоде достигнута ремиссия заболевания в виде транзиторной надпочечниковой недостаточности со стремительным восстановлением секреции кортизола (выписана без ГКС), с последующей отменой препаратов калия, спиронолактона, антигипертензивной и инсулинотерапии, а также улучшением общего состояния, постепенным перераспределением ПЖК, уменьшением роста волос и площади угревой сыпи на лице и быстрым восстановлением трудоспособности.
Заключение. Учитывая редкость описанной патологии, правильная диагностическая тактика позволяет достоверно установить диагноз и оказать своевременную медицинскую помощь до развития жизнеугрожающих кортизоли адреналин-опосредованных осложнений.
Актуальность. АКТГ-эктопический синдром является одной из редких причин эндогенного гиперкортицизма и может представлять серьезные трудности в топической диагностике.
Материалы и методы. Клинические особенности гиперкортицизма, манифестировавшего у пациента в 18-летнем возрасте (2012 г.). По результатам проведенных лабораторно-инструментальных исследований от 2013 г.: АКТГ — 113 пг/мл (0–46), кортизол суточной мочи — 2915 мкг/сут (4,3–176), в ходе ночного подавляющего теста с 1 мг дексаметазона (DX тест) кортизол крови — 1020 нмоль/л, 8 мг DX тест — 764 нмоль/л. По МРТ интактного гипофиза и КТ брюшной полости и забрюшинного пространства с контрастным усилением данных за наличие признаков объемного поражения не получено. Однако на КТ грудной клетки выявлено узелковое образование в язычковой доле левого легкого и увеличенный парааортальный лимфатический узел. Октреоскан показал отрицательный результат. В феврале 2014 г. выполнена атипичная резекция левого легкого. При гистологическом и иммуногистохимическом исследовании верифицирован типичный карциноид легкого с отрицательной экспрессией АКТГ. В связи с сохранением симптомов гиперкортицизма в послеоперационном периоде проведена двусторонняя адреналэктомия с незначительным положительным клиническим эффектом. В сентябре 2014 г. начата терапия аналогами соматостатина (октреотид длительного действия 30–40 мг/28 дней), на фоне которой уровень АКТГ оставался повышенным и увеличивался несмотря на подавление гипофизарной секреции кортикотрофов в ответ на первичную надпочечниковую недостаточность дексаметазоном в дозе 0,5 мг 4 раза в сутки (аналог малой пробы Лиддла). На МСКТ от 2015 г. визуализированы двусторонние одиночные увеличенные внутригрудные лимфатические узлы, диффузионная МРТ (ДВ-МРТ) всего тела не выявила признаков эктопической опухоли. В мае 2016 г. при повторной ДВ-МРТ обнаружено образование фиброзной ткани в верхушке левого легкого размером 9х8 мм и увеличение левых внутригрудных лимфатических узлов. Больной консультирован хирургом: в связи с отсутствием абсолютных показаний к оперативному лечению рекомендовано повторное обследование в динамике. По результатам ПЭТ-КТ с 68 Ga DOTA-TATE от 2017 г., проведенной на фоне отмены октреотида, отмечалось поглощение радиофармпрепарата. Аналогичная визуализация получена и при выполнении сцинтиграфии всего тела с тектротидом Tc-99.
Результаты. Пациенту проведено оперативное лечение в объеме: торакотомия слева, верхняя лобэктомия, лимфаденэктомия из корня левого легкого и средостения с благоприятным исходом в виде наступления ремиссии в послеоперационном периоде (падение уровня АКТГ с >2000 пг/мл до 35 пг/мл) и последующим прохождением курса химиотерапии. Гистологическое и иммуногистохимическое исследование показало атипичный карциноид легких с экспрессией АКТГ и метастазами в лимфатические узлы.
Заключение. Описанный случай подтверждает сложность топической диагностики АКТГ-эктопического синдрома, приводящую к существенной задержке хирургического лечения.
Актуальность. Инсулинома поджелудочной железы (ИПЖ) — это нейроэндокринная опухоль, избыточно вырабатывающая инсулин и приводящая к развитию гипогликемии. Единственным радикальным методом лечения ИПЖ является хирургический. Оперативное лечение зачастую сопряжено с высокими интра- и послеоперационными рисками для пожилых пациентов с отягощенной сопутствующей патологией, в связи с чем разработаны альтернативные минимально инвазивные методы лечения, такие как радиочастотная, микроволновая и лазерная абляции, эмболизация и спиртовая деструкция нейроэндокринных опухолей (НЭО) поджелудочной железы.
Материалы и методы. Пациентка Э., 81 год, с частыми эпизодами тяжелых гипогликемий с 2017 г., сопровождающихся нейрогликопеническими и вегетативными симптомами, сниженной когнитивной функцией ввиду частых эпизодов гипогликемий, а также с отягощенной сердечно-сосудистой патологией госпитализирована в НМИЦ им. В.А. Алмазова 14.02.2022 г. При поступлении были жалобы на ежедневные эпизоды снижения гликемии, пресинкопальные состояния, увеличение массы тела на 20 кг за последний год.
Результаты. Во время госпитализации выполнена проба с голоданием — через 5 часов 15 минут достигнут уровень гликемии 1,74 ммоль/л, при этом инсулин 289,4 пмоль/л, С-пептид 9,85 нг/мл. Результаты пробы подтвердили наличие эндогенного гиперинсулинизма.
Была инициирована непрерывная подача 40-процентного раствора глюкозы с помощью инфузомата с постоянной корректировкой скорости введения (оптимальная скорость 30 мл/час).
По компьютерной томографии органов брюшной полости выявлено образование в головке поджелудочной железы размерами 13х15х17 мм. По эндоультрасонографии (ЭУС) выявлено гипоэхогенное неоднородное образование размерами до 16х13 мм с умеренным кровотоком в области крючковидного отростка ПЖ. Выполнена тонкоигольная аспирационная пункция под ЭУС контролем — по результатам гистологического и иммуногистохимического исследования: мелкие однотипные клетки нейроэндокринной опухоли, экспрессирующей Isl1, insulin, Ki-67 менее 1%; по заключению: инсулинома.
Методом хирургического лечения с учетом локализации образования была панкреатодуоденальная резекция (ПДР), однако учитывая коморбидность пациентки, пожилой возраст, выявленную в ходе дообследования опухоль купола слепой кишки с признаками малигнизации, ПДР представляла риски, в связи с чем предложен альтернативный минимально инвазивный метод лечения — эндоскопическая деструкция опухоли этанолом.
11.04.2022 г. выполнена симультанная операция: первым этапом — эндоскопическая деструкция инсулиномы под ЭУС наведением. Вторым этапом — правосторонняя гемиколэктомия.
В раннем послеоперационном периоде и в течение полутора лет после операции эпизоды гипогликемии не рецидивировали, отдаленные осложнения не зарегистрированы.
Заключение. Спиртовая деструкция может быть предложена в качестве альтернативного метода лечения у коморбидных и пожилых пациентов.
Актуальность. Рак щитовидной железы (РЩЖ) относится к наиболее распространенным злокачественным новообразованиям органов эндокринной системы. Изучение клеточной морфологии позволяет подтвердить характер образования в 70–75% случаев, тогда как остальные аспираты относятся к группе категорий неопределенного цитологического заключения [Haugen BR et al., 2016]. Последнее затрудняет выбор оптимального метода лечения, и приводит в ряде случаев к избыточно агрессивной тактике ведения пациентов. С другой стороны, общеизвестны трудности цитологической диагностики таких гистологических типов типов РЩЖ, как медуллярная карцинома [Газизова Д.О. и др., 2013].
МикроРНК (миРНК) представляют собой эндогенные некодирующие РНК. Идентифицированы специфичные для каждого гистологического типа РЩЖ паттерны экспрессии микроРНК, которые в значительной степени зависят от условий окружающей среды и генетико-популяционной структуры исследуемых групп пациентов [Ferris RL et al., 2015]. ЦЕЛЬ. Разработка и освоение методики изучения экспрессии микроРНК в фиксированной формалином и залитой парафином ткани щитовидной железы (ЩЖ).
Материалы и методы. Исследовано 17 образцов ткани ЩЖ: визуально интактная ткань (6 образцов), фолликулярная узловая болезнь ЩЖ (клинически — узловой аденоматозный зоб, 9 образцов), аутоимунный тиреоидит (АИТ) с узлообразованием (2 образца).
Выделение микроРНК производилось с использованием набора LRU-100-50 (Biolabmix, Россия), синтез кДНК — набором ArtMMLV Total (АртБиоТех, Беларусь), проведение ПЦР в реальном времени — мастер-миксами производства ОДО Праймтех (Беларусь).
Для анализа графиков, полученных при проведении кПЦР, использован метод прямого сравнения графиков Cp (crossing point), реализованный в программе LinRegPCR v.11.0. Оценку изменения уровня экспрессии микроРНК в опытном образце по отношению к контрольному вычисляли по стандартной формуле [Pfaffl MW et al., 2001]. РЕЗУЛЬТАТЫ. Изучен профиль экспрессии 17 микроРНК (miR-021, miR-031, miR-125a, miR-138, miR-144, miR-146b, miR-181b, miR-187, miR-197, miR-199b, miR-200b, miR-200а, miR-205, miR-222, miR-375, miR-574, miR-885 и внутреннего контроля U6).
Большинство микроРНК изменяло степень своей экспрессии в изученных образцах по сравнению с нормальной тканью. По сравнению с контрольной микроРНК U6 микроРНК hsa-miR-187 и hsa-miR-197 характеризовались усилением экспрессии умеренной интенсивности — не более чем в 100 раз, для hsa-miR-574 была установлена повышенная экспрессия более высокой интенсивности — до 200 раз, для hsa-miR-125a и hsa-miR-138 выявлена гиперэкспрессия — в среднем более чем в 500 раз. Для hsa-miR-187, hsa-miR-197, hsa-miR-125a и hsa-miR-138 наблюдалась тенденция к возрастанию экспрессии в ряду «нормальная ткань>зоб>АИТ».
Выводы. Разработана методика изучения экспрессии микроРНК в фиксированной формалином и залитой парафином ткани ЩЖ. Установленные изменения экспрессии микроРНК требуют проведения дальнейших исследований.
АКТУАЛЬНОСТЬ. Несмотря на запросы практической эндокринологии и клинической психологии, субъективные представления пациентов о доброкачественных опухолях гипофиза в России не изучались, что снижает возможность психодиагностики и персонализированного подхода к психообразованию, лечению и реабилитации.
ЦЕЛЬ. Изучение многомерной структуры восприятия угрожающей жизни болезни пациентов с аденомами гипофиза (акромегалия и болезнь Иценко-Кушинга).
ЗАДАЧА. Выявить типологию субъективного восприятия болезни пациентов с аденомами гипофиза с разным уровнем восприятия болезни как угрозы для здоровья и жизни.
МАТЕРИАЛЫ И МЕТОДЫ. Обследовано 70 пациентов с аденомами гипофиза, находившихся на медикаментозном и хирургическом лечении в отделении нейроэндокринологии и остеопатий ФГБУ «НМИЦ эндокринологии» Минздрава РФ. Методика исследования: «Краткий опросник восприятия болезни» (Broadbent E. и др., 2006; Ялтонский В.М., Ялтонская А.В., Сирота Н.А., Московченко Д.В., 2017). По критерию уровня восприятия болезни как угрозы для здоровья выборка была разделена на 2 группы — воспринимающие болезнь как умеренную угрозу (тип 1) и как выраженную угрозу (тип 2).
РЕЗУЛЬТАТЫ. Восприятие аденом гипофиза пациентами как умеренной угрозы для здоровья (тип 1) характеризовалось оценкой переживаемых последствий заболевания как слабых, ограниченной идентификацией симптомов болезни, низкой озабоченностью и слабым эмоциональным реагированием на нейроэндокринные опухоли гипофиза. Одновременно пациенты этой группы воспринимают болезнь как понятную для них и умеренно контролируемую ими благодаря самоконтролю и успешно контролируемую благодаря современному лечению.
Восприятие болезни пациентов как выраженной угрозы для здоровья (тип 2) характеризуется оценкой переживаемых последствий болезни — выраженных: повышенной озабоченностью болезнью и эмоциональным реагированием на нее. Пациенты успешно идентифицируют болезнь по ее симптомам, что делает ее хорошо понятной им. Они воспринимают свою болезнь как умеренно контролируемую ими или умеренно контролируемую благодаря лечению.
ВЫВОДЫ. Выявленные два разных типа восприятия хронической болезни пациентом являются мишенями персонализированной психотерапии и расширяют междисциплинарной команде возможности разработать вмешательства, направленные на проведение психообразования, формирование адаптивных навыков совладания с болезнью, повышение приверженности лечению и качества жизни.
Некролог 
18 сентября 2023 года после тяжелой продолжительной болезни закончил свой земной путь доктор медицинских наук, профессор Бубнов Александр Николаевич, один из ярких незабываемых представителей Санкт-Петербургской школы эндокринных хирургов.
Объявления
2024-02-27
Николаевская научно-практическая школа эндокринной хирургии
29 февраля — 2 марта 2024 года состоится первая
«НИКОЛАЕВСКАЯ НАУЧНО-ПРАКТИЧЕСКАЯ ШКОЛА ЭНДОКРИННОЙ ХИРУРГИИ».
2021-02-25
Консультация экспертов Референс-Центра патоморфологических, иммуногистохимических и лучевых методов исследования опухолей эндокринной системы НМИЦ эндокринологии в рамках ОМС
| Еще объявления... |
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2310-3965 (Online)